| Новости | e-Образование | Врачебные Общества | Тематические группы | Библиотека | Медиатека | Мероприятия | Атлас |
Присоединяйтесь!
- Повышение квалификации
- Сертифицированное образование
- Актуальные статьи
- Обзоры и репортажи
- Клинические случаи
- Новости медицины
- Советы коллег
Сообщество: Педиатрическое Респираторное Общество
Глава 5. Клиника и диагностика бронхиальной астмы у детей
Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика.»
Диагностика бронхиальной астмы у детей строится на основании оценки данных анамнеза, жалоб и клинических симптомов, а также данных дополнительных исследований.
При сборе анамнеза необходимо уточнить следующее.
- Наличие наследственной отягощенности по БА и/или другим атопическим заболеваниям, сопутствующих аллергических заболеваний (атопического дерматита, аллергического риноконъюнктивита и т. д.) у ребенка в настоящее время или в анамнезе.
- Наличие кашля, усиливающегося преимущественно в ночное время; повторяющихся эпизодов свистящего дыхания (особенно на выдохе); повторных эпизодов затрудненного дыхания; чувства стеснения в грудной клетке, эпизодов бронхоспазма на физическую нагрузку.
- Наличие в анамнезе повторных эпизодов бронхиальной обструкции, особенно протекающих на фоне нормальной температуры.
- Ухудшение состояния в дневные, ночные или предутренние часы, при воздействии аллергенов или триггеров.
Выраженность симптомов может изменяться в течение суток и в течение года в зависимости от спектра сенсибилизации. Исчезновение симптомов при устранении контакта с аллергеном (эффект элиминации), улучшение состояния после применения бронходилататоров.
Клинически в период обострения бронхиальной астмы у детей определяется навязчивый сухой непродуктивный кашель, экспираторная одышка, диффузные сухие свистящие, преимущественно на выдохе, иногда в сочетании с разнокалиберными влажными хрипами в грудной клетке на фоне неравномерного ослабленного дыхания, вздутие грудной клетки, коробочный оттенок перкуторного звука. Нередко ребенок принимает вынужденное положение (ортопноэ), бледен, самочувствие нарушено.
Симптомы могут усиливаться ночью или в предутренние часы. Клиническая симптоматика бронхиальной астмы меняется в течение суток. Следует обсудить весь набор симптомов за последние 3–4 месяца. Свистящее дыхание должно быть подтверждено врачом, поскольку родители могут неправильно интерпретировать звуки, издаваемые их ребенком при дыхании. В стадии ремиссии симптомы могут отсутствовать, что не исключает диагноза бронхиальной астмы.
В последнее время при бронхиальной астме предлагается выделение отдельных фенотипов, что иногда может оказаться целесообразным. Это не противоречит пониманию бронхиальной астмы как единой нозологической формы, но уточняет некоторые ее типовые особенности в различных группах детей, помогая дифференциальной диагностике и выбору оптимальной терапии.
Таким образом, под фенотипами бронхиальной астмы следует понимать выделение отдельных когорт детей с возрастными, патогенетическими, клиническими особенностями этого заболевания, которые целесообразно учитывать при диагностике, подборе индивидуальной терапии и организации наблюдения этих больных. Так, бронхиальная астма имеет особенности у детей с ожирением, с гастроэзофагальной рефлюксной болезнью, с бронхоспазмом на физическую нагрузку, с непереносимостью аспирина и других нестероидных противовоспалительных средств, с психологическими особенностями.
Фенотип астмы зависит также от характера воспаления (эозинофильное, неэозинофильное).
Редкий вариант БА у детей в виде кашлевых приступов («кашлевая астма»). Жалобы на одышку/нехватку воздуха отсутствуют, а ведущим клиническим симптомом является приступообразный кашель. Патогенетическая основа кашля — аллергическое воспаление бронхов. Наблюдается преимущественно у детей раннего и дошкольного возраста. Приступы развиваются после контакта с причинно-значимым аллергеном, а углубленное обследование подтверждает атопический характер заболевания. С возрастом заболевание нередко приобретает черты типичной бронхиальной астмы.
5.1. Особенности клиники и диагностики бронхиальной астмы у детей разного возраста
Возраст — один из наиболее значимых критериев, определяющих фенотип БА у детей. На практике для этих целей можно выделить следующие возрастные группы:
- дети от 0 до 2 лет;
- дошкольники от 3 до 5 лет;
- школьники от 6 до 12 лет;
- подростки.
Дети первых двух лет жизни (0–2 года). Бронхиальная астма у детей этого возраста отличается клинической вариабельностью, при этом она сохраняет черты аллергического наследственно обусловленного заболевания. Дебют бронхиальной астмы у 70–80% больных относится к раннему детскому возрасту. Раннему развитию бронхиальной астмы у детей может способствовать внутриутробная сенсибилизация плода вследствие повышенной проницаемости фето-плацентарного барьера, обусловленной различными воздействиями. Неблагоприятные влияние оказывают профессиональные вредности, активное и пассивное табакокурение матери.
Среди факторов постнатальной сенсибилизации важное значение имеет избыточная антигенная экспозиция в первые годы жизни ребенка. У детей первого года жизни основными сенсибилизирующими факторами являются пищевые аллергены (куриный белок, белок коровьего молока, пшеница и другие злаки, рыба, орехи, какао, цитрусовые, ряд других фруктов, ягод, овощей). С первых месяцев жизни начинает возрастать роль бытовых аллергенов. Сенсибилизация к аллергенам домашней пыли и клещам определяется в этом возрасте у большинства больных. С 3–4-летнего возраста в качестве причинно-значимых аллергенов возрастает роль пыльцевых аллергенов, спектр которых различен в разных климато-географических зонах.
У большинства детей появлению первых типичных приступов экспираторной одышки, как правило, предшествуют проявления атопического дерматита, острые аллергические реакции на различные пищевые продукты, медикаменты (в виде экзантем, крапивницы, отеков Квинке), повторные респираторные заболевания. Подобные начальные проявления респираторной аллергии нередко расцениваются врачами как острые респираторные вирусные инфекции, бронхиты, пневмонии. Больные при этом неадекватно лечатся антибиотиками, что лишь способствует лекарственной сенсибилизации, проявляющейся различными клиническими вариантами лекарственной аллергии.
Подобная этапность в смене спектра сенсибилизации у детей раннего возраста хотя и характерна (так называемый «атопический марш»), однако наблюдается далеко не всегда. В последнее время у детей, больных бронхиальной астмой, все чаще отмечается ранняя сенсибилизация к широкому спектру аллергенов (полисенсибилизация).
В международных документах предлагают использовать индекс риска астмы (Asthma Predictive Index (API) для выявления факторов, предрасполагающих к БА в раннем детстве (табл. 5.1):
Таблица 5.1
| Распознаются дети с высоким риском астмы (2–3лет) >3 (4) эпизодов свистящих хрипов за последний год И |
||
|---|---|---|
| Один большой критерий | ИЛИ | Два малых критерия |
| У одного из родителей подтвержденный диагноз астмы Подтвержденный диагноз атопического дерматита Чувствительность к аэроаллергенам |
Чувствительность к пищевым аллергенам Эозинофиллия в крови (>4%) Свистящее дыхание не связано с инфекцией |
|
Неблагоприятным фоном для раннего развития бронхиальной астмы у детей являются перинатальные повреждения центральной нервной системы.
В связи с анатомо-физиологическими особенностями детей раннего возраста (узкий просвет бронхиального дерева, слабо развитый мышечный слой, значительное развитие кровеносных и лимфатических сосудов) бронхоспазм обычно не является у них ведущим механизмом в патогенезе обострений бронхиальной астмы. На первое место выступает воспаление слизистой оболочки бронхов, ее отек и гиперсекреция слизи, большая продолжительность обострений.
Провокация обструкции бронхов острой респираторной инфекцией, однотипная клиническая картина, функциональные и лабораторные изменения, объединяются в фенотип — вирус-индуцированной БА.
Сходство с обструктивным бронхитом весьма затрудняют дифференциальный диагноз. Бронхиальная астма в раннем возрасте часто не распознается, и больные лечатся нерационально.
В отличие от больных с обструктивным бронхитом для детей раннего возраста с бронхиальной астмой характерны выраженная наследственная отягощенность аллергическими заболеваниями (особенно по материнской линии); высокая частота аллергических реакций на пищевые продукты, медикаменты, профилактические прививки; более выраженные кожные аллергические проявления; бурное течение бронхообструктивного синдрома с ранним началом во время ОРИ; более отчетливый эффект бронхолитической терапии. Практически ни один из этих показателей в отдельности (в том числе уровень IgE) не может служить достаточно достоверным дифференциально-диагностическим критерием обструктивного бронхита и бронхиальной астмы.
Таблица 5.2. Клинические критерии дифференциальной диагностики бронхиальной астмы и обструктивного бронхита у детей раннего возраста с бронхообструктивным синдромом на фоне острой респираторной инфекции
| Признаки | Бронхиальная астма | Обструктивный бронхит |
|---|---|---|
| Возраст первых проявлений | старше 1 года | младше 1 года |
| Появление бронхообструктивного синдрома | с 1-го дня ОРИ | на 3-й день ОРИ и позднее |
| Эффект бронхолитической терапии | высокий | умеренный |
| Повторяемость бронхообструктивного синдрома | 3 и более | впервые возможны повторения |
| Наследственная отягощенность аллергическими заболеваниями — в том числе по материнской линии | имеется | нет |
| Наличие в анамнезе других аллергических заболеваний (атопический дерматит, аллергический ринит) | имеется | нет |
| Наличие катаральных явлений | возможно | всегда |
В этом возрасте необходимо исключать другие причины обструкции, обусловленные прежде всего респираторно- синцитиальной и другими респираторными инфекциями с поражением нижних дыхательных путей. Причинами обструкции в этом возрасте также могут быть бронхолегочная дисплазия, гастро-эзофагальный рефлюкс, аспирация инородного тела, врожденные аномалии легких и сердца, первичная цилиарная дискинезия и др.
Дошкольники (от 3 до 5 лет). У детей дошкольного возраста главным ключевым критерием дифференциальной диагностики фенотипа астмы является персистирование на протяжении последнего года. В этой возрастной группе вирусы являются наиболее частыми триггерами.
Возможна провокация приступов бронхиальной астмы физической нагрузкой в этой возрастной группе.
Нередко кожные пробы с аллергенами или определение специфических IgE-антител позволяет подтвердить аллергическую природу заболевания. При детальном опросе выявляется клинически значимая ассоциация между контактом с аллергеном и появлением симптомов.
Независимо от того, удалось выявить причинно-значимый аллерген или нет, важным для постановки диагноза в этом возрасте является отчетливый положительный эффект от применения бронходилятаторов и ингаляционных глюкокортикостероидов, а также возврат симптомов после отмены этой терапии.
Школьники (от 6 до 12 лет). Приступы в этом возрасте также наиболее часто провоцируются аллергенами, респираторными вирусами, физической нагрузкой. При выборе лечения следует прежде всего ориентироваться на предшествовавшую тяжесть заболевания.
Подростки. В этом возрасте нередко меняется тяжесть течения бронхиальной астмы, у отдельных детей приступы вообще проявляются впервые, часть детей «перерастают» заболевание. Симптомы заболевания существенно уменьшаются и даже исчезают. Сложность ведения больных этого возраста определяется появлением у многих подростков вредных привычек (табакокурения), некритичной оценкой ими своего состояния, отсутствием преемственности и нерегулярностью врачебного наблюдения, низкой приверженностью терапии.
Весьма часта провокация приступов физической нагрузкой, различными неспецифическими, в том числе психоэмоциональными факторами. Требуется дифференциальный диагноз с дисфункцией голосовых связок (возрастная мутация голоса), аспирацией инородных тел, гипервентиляционным синдромом, начальными проявлениями ХОБЛ.
5.2. Клинические особенности бронхиальной астмы у детей при сенсибилизации к различным аллергенам
Бронхиальная астма у детей, обусловленная сенсибилизацией к аллергенам Dermatophagoides pteronyssimus, Dermatophagoides farinae, домашней пыли, характеризуется возникновением более частых обострений в домашней обстановке, тогда как при выезде из дома, смене места жительства симптомы урежаются. К уменьшению частоты приступов удушья у таких больных ведет надлежащее гигиеническое содержание жилых помещений. Для клещевой бронхиальной астмы характерно возникновение приступов затрудненного дыхания в ночные часы — в период наибольшей экспозиции аллергенов микроклещей домашней пыли, присутствующих в постельных принадлежностях.
Течение грибковой БА связано с особенностями распространения грибов и концентрацией их спор в окружающей среде на протяжении года. Так, при БА, вызванной сенсибилизацией к грибам рода Cladosporium, Alternaria, приступы затрудненного дыхания обычно учащаются в период образования спор грибов,— с марта и до первых заморозков. При сенсибилизации к грибам рода Penicillium, Aspergillus, Mucor, весьма распространенных в сырых помещениях и дающих обильное образование спор круглогодично, обострения БА возникают на протяжении всего года, при проживании ребенка в сырых помещениях, а также при употреблении в пищу таких продуктов, как грибы, сыр, кислое молоко, дрожжевое тесто и т. д. Для больных грибковой БА характерно особенно тяжелое течение болезни, при этом нередки затяжные обострения, что обусловлено участием в патогенезе аллергических реакций как I, так и III типа.
Пыльцевая БА обычно возникает в разгар цветения некоторых растений и сочетается с симптомами риноконъюнктивита. В это время учащение приступов у таких детей чаще наблюдается в сухие ветреные дни — в периоды максимальной концентрации пыльцы в воздухе и, наоборот, урежение — в сырую дождливую погоду. У больных пыльцевой БА обострения болезни могут возникать также в связи с употреблением пищевых продуктов, имеющих общие антигенные детерминанты с пыльцой деревьев (яблоки, орехи, березовый сок) и трав (ржаной и пшеничный хлеб, изделия из пшеничной муки, семена подсолнуха, подсолнечное масло, халва).
БА у детей как проявление исключительно пищевой аллергии диагностируется реже, однако в комбинации с сенсибилизацией к аллергенам домашней пыли, Dermatophagoides pteronyssimus, Dermatophagoides farinae, она наблюдается довольно часто. Обычно развитие приступов пищевой БА связано с сенсибилизацией к рыбе, яйцам, цитрусовым, белкам коровьего молока. Развитию приступа затрудненного дыхания у таких больных обычно предшествуют крапивница, отек губ, иногда боли в животе, диспептические явления.
БА как проявление изолированной сенсибилизации к аллергенам домашних животных встречается лишь у отдельных больных. Чаще выявляется сочетанная сенсибилизация аллергенами домашней пыли, Dermatophagoides pteronyssimus, Dermatophagoides farinae и эпидермальными аллергенами. БА у детей с эпидермальной сенсибилизацией нередко сопровождается аллергическим ринитом. У отдельных больных с БА, вызванной сенсибилизацией к эпидермальным аллергенам, отмечается склонность к развитию крапивницы, аллергического отека.
У детей, проживающих в районах промышленных предприятий, загрязняющих окружающую среду вредными веществами, может отмечаться сенсибилизация к промышленным химическим аллергенам, подобно таковой у профессионально занятых в производствах с вредными условиями труда работников. При этом может выявляться сенсибилизация к металлам (хрому, никелю и др.), к формальдегиду, различным продуктам нефтеоргсинтеза. Для этих детей характерен более ранний дебют бронхиальной астмы, выраженный эффект элиминации, провокация приступов физической нагрузкой и другими неспецифическими факторами, экспозицией к тем или иным химическим веществам. Сенсибилизация к химическим соединениям не бывает изолированной, она всегда сочетается с повышенной чувствительностью к другим аллергенам.
В последнее время отмечается существенное нарастание частоты полисенсибилизации при БА у детей, что сопровождается политопными аллергическими проявлениями.
5.3. Бронхоспазм на физическую нагрузку
Посленагрузочный (постнагрузочный) бронхоспазм характерен для подавляющего большинства (60–90%) детей, больных БА, особенно при недостаточном контроле заболевания. Многолетние наблюдения показывают, что «бронхиальная астма физического напряжения» как самостоятельная форма заболевания у детей не встречается.
Разные виды физической нагрузки неодинаково провоцируют развитие постнагрузочного бронхоспазма: наиболее часто он развивается при беге, особенно в гору, после степ-теста, при езде на велосипеде, относительно редко — при плавании.
Развитие бронхиальной гиперреактивности, бронхоспазма, появление гиперсекреции слизи связывают с липидными медиаторами аллергии, высвобождаемыми при реагинзависимой аллергической реакции. Установлена повышенная способность к высвобождению лейкотриена С4 после физической нагрузки у детей с бронхиальной астмой, что подтверждает участие медиаторов липидной природы в реализации постнагрузочного бронхоспазма.
Постнагрузочный бронхоспазм является проявлением неспецифической гиперреактивности бронхиального дерева и, как доказано, коррелирует с тяжестью течения бронхиальной астмы. В то же время у детей с контролируемой тяжелой бронхиальной астмой существенно улучшается переносимость физической нагрузки.
Постнагрузочный бронхоспазм может развиваться у больных бронхиальной астмой в любых климатических условиях, но чаще всего при вдыхании холодного (реже — горячего) воздуха и в условиях повышенной влажности.
У большинства больных с бронхиальной астмой короткий бег (до 2 мин.) ведет к бронходилатации, которая может длиться 8–12 минут.
При более длительном беге на 4–6-й минуте от начала упражнения, как правило, развивается постнагрузочный бронхоспазм, который может быть клинически выраженным, проявляться типичным приступом удушья или, в отсутствие клинических проявлений, обнаруживаться только при динамической инструментальной оценке ФВД. Характерным для постнагрузочного бронхоспазма является снижение функциональных показателей бронхиальной проходимости; наиболее информативно снижение объема форсированного выдоха за 1 сек. (ОФВ1) более чем на 10%. Постнагрузочный бронхоспазм у большинства детей с бронхиальной астмой обычно проходит через 15–20 минут. У части больных физическая нагрузка вызывает двухфазную реакцию: раннюю (непосредственно через 3–5 минут после нагрузки) и позднюю (отсроченную — через 3–6 часов).
5.4. БА и аллергический ринит
Ключевые положения:
- АР является фактором риска развития БА;
- своевременная диагностика и адекватная терапия АР у детей всех возрастных групп могут предупредить развитие БА;
- у больных БА необходимо обследование на наличие АР; у больных с АР следует исключить БА;
- при наличии сочетания АР и БА необходимо проводить комплексную терапию в соответствии со степенью тяжести заболеваний;
- проведение АСИТ у больных АР предотвращает расширение спектра сенсибилизации и возникновение БА.
Аллергический ринит (АР) — заболевание слизистой оболочки носа, основой которого является аллергическое воспаление, вызываемое причинно-значимыми аллергенами. Клинически АР проявляется ринореей, назальной блокадой (затруднением носового дыхания вследствие непроходимости носовых ходов), зудом в полости носа, повторными эпизодами чихания и нередко аносмией.
30–40% больных АР имеют БА и более чем у 70% пациентов клинические проявления АР предшествуют манифестации БА. Аллергологическое обследование детей с отягощенным семейным анамнезом по аллергическим заболеваниям показало высокую частоту АР у детей до 5 лет и достоверную его значимость как фактора риска развития БА в школьном возрасте. Однако в этой возрастной группе АР часто диагностируется после постановки диагноза БА, что может быть связано с поздней диагностикой АР.
АР и БА являются не сопутствующими (concomitant), а коморбидными заболеваниями, в основе которых лежит как морфофункциональная общность верхних и нижних дыхательных путей, так и системные механизмы развития хронического аллергического воспаления.
В Согласительном документе Европейской академии аллергологии и клинической иммунологии Аспирация назального секрета «ARIA» (Allergic rhinitis and its impact on asthma — Аллергический ринит и его влияние на астму 2008) принята концепция «единая дыхательная система, единое заболевание».
Среди возможных механизмов, связывающих верхние и нижние дыхательные пути, следует указать: взаимосвязь между нервно-сосудистой системами верхних и нижних дыхательных путей; аспирация назального секрета и медиаторов воспаления; активация эозинофилов, базофилов, тучных клеток, лимфоцитов под воздействием аллергенов; активация врожденных (природных) стромальных и гематопоетических (кроветворных) эффекторных клеток (innate stromal and hemotopoetic eff ector cell).
Снижение барьерной функции носа приводит к повышению проницаемости слизистой оболочки для ингаляционных аллергенов, вирусов. Затруднение носового дыхания и преимущественное дыхание через рот при АР облегчает поступление аэроаллергенов в нижние отделы респираторной системы. Холодный воздух при дыхании через рот может провоцировать приступы обструкции у больных БА. Гиперсекреция слизи вызывает постназальный затек, приводящий к возникновению кашля путем стимуляции фаринголарингиальных рецепторов.
Кашель, вызванный постназальным затеком, приводит к гипервентиляции, гипокапнии и рефлекторному бронхоспазму у пациентов с БА. Имеются и значимые различия в морфологическом строении слизистой и подслизистой оболочек носа и бронхов, где аллергическое воспаление реализуется.
Слущивание эпителия более характерно для слизистой оболочки бронхов, в то время как метаплазия эпителия присутствует при АР и отсутствует при БА. Утолщение базальной мембраны и отложение коллагена при участии миофибробластов (прогностически значимый признак ремоделирования) выражены у больных БА и существенно менее значимы при АР, хотя может иметь место небольшое утолщение ретикулярной базальной мембраны. Поскольку слизистая оболочка полости носа богата сосудами, а нижние дыхательные пути имеют хорошо развитую перибронхиальную гладкую мускулатуру, обструкция полости носа в основном является результатом дилатации сосудов, в то время как бронхиальная обструкция преимущественно обусловлена спазмом гладкой мускулатуры бронхов.
При наличии сочетания АР и БА для достижения оптимальной эффективности необходима комбинированная терапия обоих заболеваний в соответствии с тяжестью каждого из них. Даже если предположить, что терапия АР не уменьшает воспаление в бронхах, то нормализация дыхания через рот, снижение постназального затека могут облегать течение БА. Лечение сочетания АР и БА интраназальными и ингаляционными ГКС улучшает течение БА у детей, приводит к снижению числа обращений за неотложной помощью и госпитализаций. Отмечено снижение количества эозинофилов в мокроте при комбинированном лечении ГКС по сравнению с терапией только ингаляционными ГКС.
Безусловно, лечение только интраназальными стероидами при сочетании заболеваний не оказывает влияния на течение БА и не должно быть использовано.
5.5. Бронхиальная астма и атопический дерматит
Ключевые положения:
- АД в раннем детском возрасте является фактором риска развития БА у детей, подростков и взрослых. У 1/3 детей с АД присоединяется БА;
- тяжесть АД является фактором высокого риска развития БА;
- сочетанные кожные и респираторные проявления аллергии характеризуются поливалентной сенсибилизацией, сопровождаются эозинофилией, высокими уровнями общего и специфических IgE в сыворотке крови;
- для профилактики БА у детей с атопическим дерматитом необходимо адекватное комплексное лечение даже минимальных кожных проявлений аллергии.
Развитие атопии обычно начинается с ранней сенсибилизации к пищевым аллергенам. Поэтому эта сенсибилизация часто рассматривалась в качестве фактора риска и предиктора других проявлений атопии, в особенности астмы. Вместе с тем важно знать, что ранняя сенсибилизация к пищевым аллергенам сама по себе не является фактором риска для развития астмы.
Проведение масштабных когортных исследований детей с рождения, направленное на изучение заболеваемости всеми аллергическими заболеваниями, стартовавшее в Германии в 1990 г. (Немецкое мультицентровое исследование аллергии, Multicenter Allergy Study — MAS- 90), охватило более чем 1300 новорожденных. Детальный анализ распространения аллергических заболеваний в различных возрастных группах показал, что так называемый атопический жизненный цикл характеризуется общностью фенотипов, который выражается в развитии различных атопических заболеваний в различные периоды жизни больного.
Оценка результатов MAS исследования показала, что риск развития бронхиальной астмы у школьников прослеживался только в группе детей с ранней сенсибилизацией к пищевым аллергенам с последующим развитием сенсибилизации к ингаляционным аллергенам. Дети только с пищевой сенсибилизацией без развития последующей сенсибилизации к ингаляционным аллергенам в школьном возрасте не представляют группу риска по бронхиальной астме, как и дети без сенсибилизации.
Аллергический марш АД тесно связан с другими атопическими заболеваниями: 30–60% больных АД развивают БА, 35–66% АР. Исследование, проведенное в Тасмании в 1968 г. (8000 детей в возрасте 6–7 лет, которые затем были обследованы в возрасте 44 лет), показало, что изолированный АД в детстве повышал риск развития атопической БА к среднему возрасту в 4,1 раза.
«Клинические проявления аллергии в детстве появляются с характерной последовательностью. Однако причинной ассоциации между ранними и поздними проявлениями может не наблюдаться. Различные клинические проявления могут проявиться вследствие разного соотношения генетических и средовых факторов, различного возраста и пола» (U. Wahn, P. M. Matricardi). Исследования последних лет показали, что мутации в гене, кодирующем экспрессию белка филаггрин (1q21), являются главным предрасполагающим фактором в развитии АД. Филаггрин-зависимый АД составляет до 50% всех больных АД. Отмечено, что мутации филаггрин-гена ассоциированы с повышенным риском развития БА, но только у пациентов с АД.
Степень тяжести АД является фактором высокого риска развития БА. Длительное наблюдение (в течение 8 лет) за течением атопического дерматита, проведенное в Германии, показало, что у 43% детей наблюдалось развитие БА, а у 45% — аллергического ринита. Причем БА чаще возникала у детей с тяжелым течением атопического дерматита — у 70%, при легком — только у 30% детей.
Наблюдения последних лет свидетельствуют о том, что имеется отчетливая тенденция к увеличению числа больных с сочетанными формами кожной и респираторной аллергии. Частота сочетанных кожно-респираторных проявлений аллергии в структуре аллергических заболеваний у детей зависит от возраста и достигает 50–65%. Сочетание бронхиальной астмы с АД (дерматореспираторный синдром) обусловливает наиболее тяжелое течение заболевания, при котором периодически возникают обострения как атопического дерматита, так и БА, с кратковременными ремиссиями, резистентностью к медикаметозной терапии, снижением качества жизни больного ребенка и всей семьи в целом. Одной из особенностей ДРС является поливалентная сенсибилизация с гиперчувствительностью к аллергенам домашней пыли, Dermatophagoides pteronyssimus, Dermatophagoides farinae, грибковым, пыльцевым, пищевым, лекарственным аллергенам. Течение БА у таких детей наиболее упорное, сопровождается эозинофилией, высокими уровнями общего и специфических IgE в сыворотке крови, гастроинтестинальной аллергией.
5.6. Бронхиальная астма у детей с ожирением
Согласно ряду исследований существует связь между ожирением и увеличением риска развития БА у детей. Установлено, что эта взаимосвязь в некоторой степени может быть обусловлена генетической составляющей. БА у девочек, страдающих ожирением (ИМТ>85%), встречается достоверно чаще в сравнении с аналогичной по половому признаку группой детей, имеющих нормальную массу. При этом распространенность БА у девочек ассоциирована преимущественно с абдоминальным ожирением.
Ряд исследований показали влияние паратрофии при рождении и ожирения в детском возрасте на риск развития БА в будущем. При этом отмечено, что относительный риск формирования бронхиальной астмы в подростковом возрасте у детей, имеющих высокую массу тела в перинатальном периоде и в раннем детстве был выше на 50% в сравнении с аналогичными по возрасту группами без признаков ожирения.
Помимо оценки ожирения у детей и подростков как предиктора формирования БА сегодня актуальным является изучение влияния избыточной массы тела на функцию легких как у лиц, страдающих БА, так и без нее. Установлено, что степень ожирения ассоциирована с изменениями ФВД, ожирение ассоциировано со снижением ОФВ1, форсированной жизненной емкости легких (ФЖЕЛ), жизненной емкости легких (ЖЕЛ), функциональной остаточной емкости и резервного объема выдоха. Преимущественно рестриктивный характер нарушений легочной функции обусловлен излишним отложением жира на диафрагме и внутренней поверхности стенок грудной клетки.
У больных БА с избыточной массой тела отмечается ряд особенностей:
- относительно низкие легочные объемы по сравнению с лицами, имеющими нормальную массу;
- отрицательная корреляционная зависимость ИМТ с диаметром дыхательных путей (максимально выражена в популяции лиц мужского пола);
- низкая функциональная активность дыхательной мускулатуры, что ассоциировано со снижением максимального давления вдоха;
- снижение экскурсии грудной клетки;
- усиление сократительного ответа гладкой мускулатуры бронхов в ответ на контрактильные стимулы, обусловливающие удлинение актов вдоха и выдоха.
Помимо этого отмечено, что жировая ткань обладает некоторым стимулирующим действием в отношении воспалительной активности при БА, поскольку продуцирует целый ряд провоспалительных медиаторов, многие из которых непосредственно участвуют в патогенезе заболевания. Ожирение и БА независимо ассоциированы с большей распространенностью симптомов гастроэзофагеальной рефлюксной болезни (ГЭРБ) в детской популяции. Поэтому при наличии у пациента избытка массы тела вероятность негативного влияния симптомов ГЭРБ на контроль БА значительно увеличивается.
Взаимосвязь ожирения и бронхиальной астмы позволяет рекомендовать рациональное питание и профилактику ожирения. Обогащение диеты ω3-полиненасыщенными жирными кислотами, особенно в комбинации с элиминационными мероприятиями, может существенно уменьшить симптомы бронхиальной астмы и улучшить качество жизни. Диетотерапия и мероприятия по снижению массы у больных ожирением и БА могут привести к значительному приросту дыхательных объемов ФВД при похудании.
5.7. Бронхиальная астма у детей с гастроэзофагеальной рефлюксной болезнью
Известно, что гастроэзофагеальный рефлюкс (или гастроэзофагеальная рефлюксная болезнь — ГЭРБ) может провоцировать приступы бронхиальной астмы у детей. Частота сопутствующей ГЭРБ у больных бронхиальной астмой колеблется от 7 до 65%. Лечение ГЭРБ само по себе не приводит к кардинальному улучшению течения бронхиальной астмы, но в ряде случаев может привести к облегчению астматических проявлений. В случае наличия легочной симптоматики у детей с ГЭРБ необходимо проведение дифференциального диагноза между истинной бронхиальной астмой и внепищеводными проявлениями ГЭРБ, которые могут сопровождаться гиперчувствительностью верхних дыхательных путей, рецидивами бронхита, и при этом бронхиальной астмой не являются.
5.8. Бронхиальная астма у детей с вегетативными нарушениями
Важное место при бронхиальной астме у детей занимают гипервентиляционные нарушения, которые включают неадекватную гипервентиляторную реакцию на различные воздействия. В формировании гипервентиляционных нарушений принимают участие эндогенные и экзогенные факторы, и сама гипервентиляция нередко провоцирует приступ удушья. В развитии бронхообструкции при гипервентиляции важное место занимает снижение температуры и влажности секрета в респираторном тракте, что способствует повышению бронхиальной реактивности. В группе детей с положительной гипервентиляционной пробой чаще отмечаются вегетативная дисфункция и нарушение процессов регуляции, в связи с чем такие больные нередко наблюдаются с диагнозами «астеновегетативный синдром», «вегетососудистая дистония». У детей с преобладанием тонуса симпатической вегетативной нервной системы отмечается большая склонность к гипервентиляторным реакциям.
В этой группе детей наблюдаются некоторые особенности течения бронхиальной астмы, связанные с «вегетативными симптомами». Чаще отмечается затруднение вдоха во время приступов, субъективное ощущение нехватки воздуха, вздохи, нарушения поведения (тревожность, эмоциональная лабильность), головные боли, сердцебиение, боли в животе во время приступа. Нередко приступы развиваются при эмоциональных стрессах, физических нагрузках. Склонность к гипервентиляции подтверждается тенденцией к гипокапнии. Поддерживают и усиливают эти проявления сопутствующая патология желудочно-кишечного тракта, эндокринной системы, отклонения со стороны центральной и вегетативной нервной системы. Бронхоспазм после физической нагрузки также (по крайней мере, частично) является следствием воздействия гипервентиляции на дыхательные пути. Улучшение достигается комплексной терапией, обязательно включающей, наряду с бронхолитиками, вегетотропную терапию, дыхательные упражнения, направленные на поддержание нормального стереотипа дыхания во внеприступном периоде.
5.9. Непереносимость аспирина и других нестероидных противовоспалительных средств («аспириновая триада»)
«Аспириновая триада» включает анафилактоидную чувствительность к нестероидным противовоспалительным препаратам, приступы удушья, наличие риносинусита и носовых полипов, наблюдается у части детей с бронхиальной астмой. Распространенность аспириновой триады, подтверждается пероральным провокационным тестом, у детей не превышает 3–5%.
Термин «аспириновая астма» у детей весьма условен, так как обострения астмы возникают не только при приеме аспирина, но и других нестероидных противовоспалительных препаратов (НПВП), ингибирующих активность циклооксигеназы (ЦОГ) и угнетающих синтез простагландинов. Это приводит к усилению липоксигеназного пути метаболизма арахидоновой кислоты клеточных мембран. Продуктами 5-липоксигеназного пути превращения арахидоновой кислоты являются цистениловые лейкотриены (ЛТ), такие как ЛТ C4, D4, E4. Они являются мощными провоспалительными медиаторами и могут вызывать бронхоконстрикцию, усиливать секрецию слизи, способствовать отеку слизистой оболочки дыхательных путей, стимулировать миграцию эозинофилов в воздухоносные пути. Как правило, непереносимость НПВП у детей сочетается с проявлениями атопии и в изолированном виде встречается крайне редко.
Диагностика аспириновой непереносимости у детей представляет большие трудности. Между тем ее распознавание необходимо, так как прием больными нестероидных противовоспалительных препаратов или лекарственных средств, их содержащих, чреват тяжелыми осложнениями, развитием анафилактических проявлений, асфиктического синдрома, а иногда драматическими последствиями.
Методы диагностики аспириновой непереносимости с помощью провокационных проб с аспирином, основанные на регистрации показателей внешнего дыхания после приема больными малых доз препарата, не могут быть рекомендованы у детей ввиду их опасности. Непереносимость НПВП выявляется методом, основанным на способности лейкоцитов больных высвобождать лейкотриены под воздействием НПВП in vitro.
Этим больным требуется терапия глюкокортикостероидами и антилейкотриеновыми препаратами. Детям с непереносимостью НПВП противопоказаны лекарственные препараты, обладающие антициклооксидазной активностью, а также медикаменты, в состав которых входит желтый пиразолоновый краситель — тартразин. Наиболее безопасными НСПВ для аспирин-чувствительных пациентов является ацетаминофен (пара-ацетаминофенол, или парацетамол).
5.10. Психологические аспекты бронхиальной астмы у детей
Известно, что длительное хроническое заболевание обусловливает задержку эмоционального развития («эмоциональную незрелость»), усиливает черты алекситимии, неспособность отличить эмоциональные проблемы от переживаемых физических нарушений. Хроническая физическая и психическая астения тормозит развитие активных форм деятельности, способствует формированию таких черт личности, как робость, боязливость, неуверенность в себе. Эти же свойства обусловливают и создание для больного ребенка режима ограничений и запретов. Условия гиперопеки формируют искусственный инфантилизм. У большинства детей с бронхиальной астмой отмечается стремление к здоровью, появляются интересы и рассуждения, свойственные взрослым. Специфические личностные нарушения у них не выявляются, больные с бронхиальной астмой не отличаются от других детей в приобретении навыков, учебе.
Около 25–30% обострений заболевания связаны с периодами эмоционального напряжения. Эмоциональный стресс сам по себе может быть пусковым фактором обострения бронхиальной астмы. Смех, плач, страх, психологическое давление в семье могут привести к гипервентиляции и реакции бронхоспазма. К такому же эффекту приводят приступы паники у детей с бронхиальной астмой.
Для успешного лечения и реабилитации больного с БА необходима оценка его эмоциональной сферы, изучение поведения ребенка с родителями, дома, в школе, среди друзей, оценка реакций ребенка на непосредственное окружение, стресс. В снижении стрессоустойчивости у детей с бронхиальной астмой важная роль отводится напряженной семейной ситуации, психологическим особенностям родителей, наличию у них психопатологии, нарушениям внутрисемейных взаимоотношений.
Нормализация жизни в семье, школе, исключение стрессовых ситуаций, чрезмерных нагрузок оказывают положительное влияние на терапию бронхиальной астмы.
Важное место занимают образовательные программы (Астма-школы), индивидуальная и групповая психокоррекция, осуществляемые психологом-психотерапевтом.
5.11. Функция внешнего дыхания
Исследование функции внешнего дыхания (ФВД) у детей старше 5–6 лет является обязательным для диагностики и оценки степени тяжести и контроля бронхиальной астмы. Обструкция наиболее резко выражена во время обострения БА и в меньшей мере может сохраняться и после исчезновения клинических симптомов.
Важным отличием от других хронических болезней легких является обратимость обструкции.
Состояние функции внешнего дыхания у больных зависит в первую очередь от периода болезни (обострение, ремиссия). Тяжесть бронхиальной астмы у детей не всегда коррелирует с показателями функции внешнего дыхания. У больных с тяжелым персистирующим, неконтролируемым течением БА трудно добиться полной нормализации функциональных показателей.
Вентиляционные нарушения легочной функции, тип нарушений (обструктивный, рестриктивный или смешанный) можно измерить с помощью спирометрии и пневмотахометрии.
Современные спирометры позволяют оценивать основные параметры (объем, поток и время) и их взаимосвязь с помощью кривых «потокобъем» и «объем-время». С помощью маневра форсированного выдоха измеряют форсированную жизненную емкость легких (ФЖЕЛ), объем форсированного выдоха в первую секунду (ОФВ1) и его отношение к ФЖЕЛ (ОФВ1/ФЖЕЛ), пиковую объемную скорость (ПОС) и другие показатели воздушного потока. При обструктивном типе нарушений наиболее информативным показателем является ОФВ1. Важным спирометрическим показателем является отношение ОФВ1/ФЖЕЛ, которое обычно выражается в процентах и является модификацией индекса Тиффно (ОФВ1/ЖЕЛвд, где ЖЕЛвд — максимальный объем).
Таблица 5.2. Должные значения ПСВ (л/мин)*
| Рост, см | мальчики | девочки | ||
|---|---|---|---|---|
| 5–14 | 15 | 5–14 | 15 | |
| 100 | 24 | — | 39 | — |
| 105 | 51 | — | 65 | — |
| 110 | 77 | — | 92 | — |
| 115 | 104 | — | 118 | — |
| 120 | 130 | — | 145 | — |
| 125 | 156 | — | 171 | — |
| 130 | 183 | — | 197 | — |
| 135 | 209 | — | 224 | — |
| 140 | 236 | 414 | 250 | 348 |
| 145 | 262 | 423 | 276 | 355 |
| 155 | 440 | 329 | 366 | 366 |
| 160 | 488 | 356 | 371 | 371 |
| 165 | 368 | 456 | 382 | 76 |
| 170 | 394 | 463 | 408 | 381 |
| 175 | 421 | 469 | 435 | 385 |
| 180 | — | 479 | — | 390 |
| 185 | — | 482 | — | 394 |
| 190 | — | 488 | — | 398 |
* По Godfrey S., Kamburoff P.L, Nairn J.R. Spirometry, lung volumes and airway resistance in normal children aged 5 to 18 years // Br. J. Dis. Chest. 1970. V. 64. P. 15
Таблица 5.3. Должные значения ПСВ в зависимости от роста (л/мин)*
| Рост 109 | 112 | 114 | 117 | 119 | 122 | 124 | 127 | 130 | 132 | 135 | 137 |
| ПСВ 147 | 160 | 173 | 187 | 200 | 214 | 227 | 240 | 254 | 267 | 280 | 293 |
| Рост 140 | 142 | 145 | 147 | 150 | 152 | 155 | 158 | 160 | 163 | 165 | 167 |
| ПСВ 307 | 320 | 334 | 347 | 360 | 373 | 387 | 400 | 413 | 427 | 440 | 454 |
* По Polger G., Promedhat V. Pulmonary Function Testing in Children: Techniques Standards. Philadelphia: W. B. Saunders Co., 1971.
Оценку функции внешнего дыхания в условиях форсированного выдоха можно осуществлять у детей в возрасте 5–6 лет и в отдельных случаях у детей с возраста трех лет. Оценка показателей проводится по степени отклонения абсолютных значений от должных величин, обычно учитывающих рост. Некоторые должные величины также учитывают возраст и пол, однако большинство исследователей полагают, что рост у детей является основным фактором. Перед началом исследования обязательна калибровка оборудования. Необходимо учитывать факторы, влияющие на результат спирографии: степень кооперации, тренированность и тревожность пациента, недавно перенесенную острую респираторную инфекцию верхних дыхательных путей, выраженные нарушения осанки.
Признаком правильной техники выполнения спирографического исследования является воспроизводимость результатов с разбросом значений менее 5%.
При нормальной функции легких отношение ОФВ1 к ФЖЕЛ составляет более 90%. Любые значения ниже приведенных могут предполагать бронхиальную обструкцию. В пользу диагноза бронхиальной астмы также свидетельствует увеличение ОФВ1 по крайней мере на 12% после ингаляции бронхолитика (200 мкг сальбутамола), что говорит об обратимости бронхиальной обструкции. Для правильной оценки теста, если пациент получает бронхолитики, их необходимо до начала исследования отменить: β2 — агонисты короткого действия — за 6 часов, β2 — агонисты длительного действия — за 12 часов, пролонгированные теофиллины — за 24 часа. Дозы бронхолитиков при проведении теста:
Сальбутамол (дозированный аэрозоль);
- детям до 7 лет — одна доза
- детям старше 7 лет — две дозы
- Беродуал Н (дозированный аэрозоль):
- детям до 7 лет — одна доза
- детям старше 7 лет — две дозы
Способы расчета бронходилятационного теста:

Пикфлоуметрия (определение пиковой скорости выдоха, ПСВ) — важный метод диагностики и последующего контроля за течением бронхиальной астмы у пациентов старше пяти лет с целью ежедневного объективного мониторинга течения бронхиальной астмы. Тест выполняется в положении стоя. Ребенку необходимо объяснить, что он должен набрать в легкие как можно больше воздуха, а затем выдохнуть этот воздух максимально быстро. Форсированный выдох выполняется трижды, и максимальное значение выбирается в качестве исходного, с которым сравниваются все дальнейшие измерения как при мониторировании функции дыхания в домашних условиях, так и при последующих визитах к врачу.
В таблице 5.2 приведены нормативы ПСВ у детей и могут служить ориентиром для оценки полученных показателей у конкретного ребенка. Тем не менее в каждом случае важно определить индивидуальную норму как максимально достигаемый результат при достижении полного контроля над заболеванием.
Наиболее информативно измерение утренних и вечерних показателей ПСВ, а в случае приема бронхорасширяющих препаратов — утром, до и вечером, после их применения. Вариабельность ПСВ — важный критерий тяжести и стабильности состояния, так как она коррелирует с гиперреактивностью дыхательных путей. Вариабельность ПСВ рассчитывают по суточным и недельным разбросам утренних и вечерних показателей.
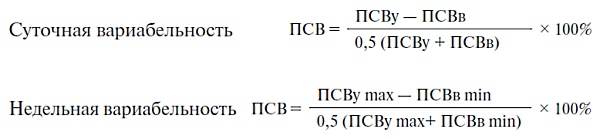
Информативен ежедневный мониторинг ПСВ в течение 2–3 нед для определения лучших индивидуальных показателей. Ведение дневников для записи симптомов, результатов пикфлоуметрии и объема терапии играет важную роль в выработке стратегии лечения бронхиальной астмы. Если ПСВ увеличивается по крайней мере на 15% (не менее 200 мл) после ингаляции бронхолитика, это свидетельствует о наличии бронхиальной обструкции.
При пневмотахометрии об обструкции бронхов судят по форме кривой «поток-объем» и снижению скоростных показателей потока выдыхаемого воздуха.
Восстановление функции легких отстает от клинического улучшения. Когда у детей уже нет ощущения удушья и затрудненного дыхания, бронхиальная проходимость, по данным функциональных исследований, еще остается нарушенной практически у всех больных, а после исчезновения свистящих хрипов в легких — по крайней мере у половины. При этом спирометрические показатели ОФВ1 и ОФВ1/ ФЖЕЛ могут быть в пределах нормы, но по кривой «поток-объем» выявляется обструкция периферических бронхов — уменьшена скорость потока форсированного выдоха во второй половине кривой «поток-объем»: МОС50, МОС75, МОС25-50, МОС75-85. Снижение скоростей потока как на кривой «поток-объем», так и на спирограмме, и не только в конце форсированного выдоха, но и в его начале (МОС25, ПСВ, ОФВ1) указывает на генерализованный характер обструкции.
Недооценка функционального состояния легких и преждевременное прекращение лечения могут вновь привести к ухудшению состояния. Нормальные показатели функции внешнего дыхания в периоде ремиссии бронхиальной астмы не означают отсутствия гиперреактивности бронхов, а неполное восстановление бронхиальной проходимости почти всегда сопровождается бронхиальной гиперреактивностью.
Исследование функции внешнего дыхания при бронхиальной астме является непременным компонентом оценки состояния больного. Лечение также должно проходить под контролем функциональных исследований.
В педиатрической практике бронхоконстрикторные тесты не являются основным функциональным методом подтверждения диагноза бронхиальной астмы. Тем не менее их использование имеет диагностическое значение в некоторых сомнительных случаях в подростковом возрасте.
Суть бронхоконстрикторного теста, независимо от ингалируемого агента, состоит в следующем: в ходе теста больной вдыхает ступенчато возрастающие по концентрации агенты; после каждой ингаляции проводится измерение ОФВ1, при регистрации 20% падения которого определяется кумулятивная доза бронхоконстрикторного агента (PD20) — это и есть мера гиперреактивности.
Бронхоконстрикторные тесты с применением метахолина, гистамина, физической нагрузки методически разработаны и стандартизированы. Последнее необходимо не только для повышения точности методики, но и для безопасности пациента (для исключения передозировки бронхоконстриктора и развития тяжелого бронхоспазма).
Для выявления посленагрузочного бронхоспазма используется 6-минутный протокол нагрузки бегом. Могут отмечаться два варианта начала бронхоспазма, индуцированного физической нагрузкой у детей с БА (при падении ОФВ1 более 15% от исходного показателя): первый вариант — классический посленагрузочный бронхоспазм, который начинается немедленно после окончания физической нагрузки, и второй вариант — «прерванный» посленагрузочный бронхоспазм, отмечаемый между 6-й и 10-й минутой нагрузки.
Исследование функции внешнего дыхания у детей дошкольного возраста Наибольшие трудности исследования функции внешнего дыхания возникают у детей первых лет жизни, так как они не могут выполнять традиционные дыхательные маневры и обследоваться методом стандартной спирографии.
Отсутствие возможности исследования функции внешнего дыхания в этом возрастном периоде затрудняет раннюю диагностику респираторной патологии, включая бронхиальную астму.
Согласно официальному заявлению ATC/ERS (2007), исследование легочной функции у детей дошкольного возраста осуществимо. В то же время необходимо учитывать ряд важных особенностей, присущих этому возрасту. Для детей этого возраста характерен короткий период внимания, когда они могут сконцентрироваться на исследовании и выполнить его адекватно.
Методы исследования функции внешнего дыхания у детей дошкольного возраста
- импульсная осциллометрия;
- определение сопротивления дыхательных путей методом прерывания воздушного потока (Rint);
- методы анализа частотно-амплитудных характеристик звуковой волны дыхания (бронхофонография);
- сопротивление воздухоносных путей, измеренное методом плетизмографии;
- форсированная спирометрия со специальными детскими программами («жевательная резинка», «коктейль», «свечи», «свисток» и пр.);
- оценка функционального остаточного объема техникой разведения газов;
- измерение индексов разведения газов;
- капнография;
- максимальный поток, характеризующий функциональный остаточный объем (V maxFRC).
В отечественной педиатрической практике наибольшее применение и развитие в получили первые три из перечисленных выше методов. Импульсная осциллометрия может использоваться у детей дошкольного возраста для оценки бронхиальной проходимости, и особенно ее лабильности. Учитывется пороговая величина, характеризующая бронходилатирующий ответ — 28% для показателя Rrs и 35% — для Xrs. С помощью определения сопротивления дыхательных путей методом прерывания воздушного потока также можно оценить бронхиальную проходимость. Повышенное сопротивление свидетельствует о наличии бронхиальной обструкции у детей с бронхиальной астмой. Уменьшение показателя Rint после бронхолитического средства по крайней мере на 20% следует рассматривать как положительный тест, т. е. наличие обратимости бронхиальной обструкции.
Разработаны и продолжают совершенствоваться методы для оценки функции легких на основе изучения частотно- амплитудных характеристик звуковой волны дыхания. При обструкции появляются высокочастотные колебания, которые могут быть выявлены с помощью бронхофонографии. Изучаются диагностические возможности для широкого использования данного метода, особенно у детей раннего возраста, в том числе для оценки степени обратимости бронхиальной обструкции.
Исследование газов крови и кислотно-основного состояния особенно необходимо при тяжелых приступах, так как оно определяет меры интенсивной терапии. Бронхиальная астма вызывает значительные нарушения газообмена только во время тяжелых приступов. Степень артериальной гипоксемии коррелирует с тяжестью обструкции дыхательных путей. При легких и умеренных приступах возникает гипокапния за счет возрастания интенсивности дыхания. Увеличение PCO2 указывает на тяжелую обструкцию, мышечную слабость, альвеолярную гиповентиляцию.
Пульсоксиметрия — важный метод оценки состояния при тяжелом приступе бронхиальной астмы. Определение уровня сатурации оксигемоглобина отражает в большей степени вентиляционно-перфузионные нарушения, чем состояние вентиляционной функции легких. Метод клинически значим и легко выполним.
5.12. Аллергодиагностика
Наиболее распространенными тестами для выявления причиннозначимых аллергенов являются кожные пробы (скарификационные или уколочные — prick test), определение специфических IgE-антител в сыворотке крови. Эти исследования дают возможность подтвердить аллергическую природу заболевания, определить спектр сенсибилизации и выявить причинные факторы, что может быть использовано при разработке лечебно-профилактических мероприятий (в том числе для планировании АСИТ) и для контроля факторов окружающей среды. Результаты аллергологического обследования у детей необходимо всегда сопоставлять с данными анамнеза, клиническими проявлениями и результатами других методов диагностики.
Тесты следует выполнять по стандартизированной методике, с контролем (гистамин и физраствор) и стандартизированными экстрактами аллергенов. При выборе тестируемых аллергенов следует принимать во внимание возраст ребенка, особенности клинической картины. Антигистаминные и системные ГКС должны исключаться до проведения тестов.
Кожные пробы можно проводить у детей любого возраста. В связи с тем, что кожные пробы у детей раннего возраста менее чувствительны, велика роль тщательно собранного анамнеза и оценки уровня сенсибилизации методами in vitro.
Определение в сыворотке крови (in vitro) аллергенспецифических IgE может оказаться полезным в том случае, когда выполнение кожных проб не представляется возможным (из-за выраженного атопического дерматита/экземы).
Полученные результаты необходимо сопоставить с данными клинического наблюдения и результатами кожных тестов. Уровень IgE в сыворотке повышен только примерно в половине случаев у пациентов с аллергическими заболеваниями. Уровень IgE может быть полезен для расчета дозы у детей, получающих терапию моноклональными IgEантителами. Повышение выше 1000нг/мл (1ЕД=2,4нг) может быть обусловлено наличием других заболеваний (атопический дерматит) или требует дифференциальной диагностики (аллергический бронхолегочный аспергиллез).
Ингаляционные провокационные тесты с аллергенами опасны из-за риска развития жизнеугрожающих состояний, обострений бронхиальной астмы у детей практически не применяются.
5.13. Другие инструментальные и лабораторные методы диагностики
Тесты на количество эозинофилов в крови и мокроте не являются обязательными для установления диагноза, хотя возможно их использование для контроля терапии. Снижение эозинофилов в мокроте может быть показателем ответа на терапию ИКС и контроля заболевания.
Повышение числа эозинофилов >1000/мкл периферической крови может указывать на паразитарную инвазию, лекарственную аллергию, или такие заболевания, как аллергический легочный аспергиллез или Churg-Strauss синдром. Выявление эозинофилов в назальном секрете иногда полезно, но специфичность его низкая.
В сыворотке крови нередко выявляют повышенные уровни эозинофильного катионного белка, интерлейкинов 5, 8, 13, лейкотриенов С4, D4 и Е4, что характерно для аллергического воспаления и коррелирует с его интенсивностью.
При микроскопии мокроты (возможен метод исследования индуцированной мокроты после ингаляции 4% раствора NaCl) детей с бронхиальной астмой могут выявляться эозинофилы, а в некоторых случаях — спирали Куршмана.
Повышение уровеня оксида азота в выдыхаемом воздухе (eNO) коррелирует с аллергическим воспалением дыхательных путей и уменьшается на фоне адекватно подобранной базисной противовоспалительной терапии бронхиальной астмы.
Анализ конденсата выдыхаемого воздуха (КВВ) также является простым и неинвазивным методом оценки воспаления в дыхательных путях, мониторинга эффективности проводимого лечения. Для пациентов с бронхиальной астмой в КВВ в периоде обострения характерно снижение рН при увеличенных уровнях перекиси водорода (Н2О2), лейкотриенов С4, D4 и Е4, некоторых интерлейкинов и метаболитов оксида азота.
Бронхоскопия/бронхофиброскопия для диагностики бронхиальной астмы не применяется, так как эндоскопическая картина неспецифична и сопровождает многие обструктивные и необструктивные болезни органов дыхания. Использование бронхоскопии/бронхофиброскопии с бронхоальвеолярным лаважом как диагностического исследования может оказаться целесообразным в затруднительных случаях — для дифференциальной диагностики бронхиальной астмы с врожденными пороками развития бронхолегочной системы, инородным телом, затяжными бронхитами неясной этиологии.
Рентгенологическая картина вариабельна и неспецифична. Для периода обострения характерны признаки эмфизематозного вздутия легочной ткани, уплощение куполов диафрагмы, горизонтальное расположение ребер и другие признаки бронхиальной обструкции. Возможно развитие ателектазов и эозинофильных инфильтратов, которые иногда принимают за пневмонию, но быстрое их исчезновение позволяет ее исключить. В периоде ремиссии сохраняются признаки обструктивного синдрома, но рентгенологические изменения могут отсутствовать У отдельных пациентов для исключения интерстициального легочного заболевания, бронхоэктазов, бронхиолита или инфекции показано проведение КТ легких. При сочетании БА с аллергическим риносинуситом рассматривается необходимость проведения КТ пазух носа.
В диагностически сложных случаях может потребоваться выполнение томографического сканирования грудной клетки или определение суточного рН пищевода.
5.14. Дифференциальная диагностика бронхиальной астмы у детей
Диагностика бронхиальной астмы у детей, особенно в раннем возрасте, представляет значительные трудности, так как периодически появляющиеся эпизоды бронхиальной обструкции могут быть проявлением самой разнообразной патологии органов дыхания. При этом следует иметь в виду, что чем меньше возраст ребенка, тем выше вероятность того, что повторяющиеся эпизоды обструктивного синдрома бронхиальной астмой не являются. Дифференциально — диагностический ряд включает большой перечень заболеваний (табл. 5.4)
Таблица 5.4. Дифференциальная диагностика бронхиальной астмы у детей
| Заболевания верхних дыхательных путей | Заболевания нижних дыхательных путей | Прочие состояния |
|---|---|---|
|
|
|
Дифференциальная диагностика астмы зависит от возраста больного. У детей младше пяти лет эпизоды БОС встречаются очень часто и далеко не всегда являются первыми признаками астмы. Рассматривают три группы БОС. Один — преходящий, непостоянный БОС у детей младше трех лет. Это состояние чаще всего связано с курением матери во время беременности и пассивным курением после родов. Второй — постоянный, повторяющийся БОС у ребенка без проявлений атопии и с неотягощенной наследственностью по атопии — чаще связан с повторными эпизодами респираторной вирусной инфекции. Частота эпизодов снижается с возрастом, и они редко повторяются у детей старше 11 лет, 3 — повторные эпизоды БОС у ребенка с отягощенной наследственностью по аллергическим заболеваниям и с проявлениями атопии. В этом случае высока вероятность бронхиальной астмы.
Заподозрить отличное от бронхиальной астмы заболевание может помочь выявление следующих симптомов:
- по данным анамнеза:
- появление симптомов заболевания с рождения;
- респираторный дистресс синдром и/или применение ИВЛ в периоде новорожденности;
- неврологическая дисфункция в неонатальном периоде;
- отсутствие эффекта от применения бронхолитиков и отсутствие ответа на терапию даже высокими дозами ингаляционных и пероральных глюкокортикостероидов;
- свистящие хрипы, связанные с кормлением или рвотой;
- затруднение глотания и/или рецидивирующая рвота;
- диарея;
- плохая прибавка массы тела;
- длительно сохраняющаяся потребность в оксигенотерапии;
- по данным физикального обследования:
- деформация концевых фаланг пальцев в виде «барабанных палочек»;
- шумы в сердце;
- стридор;
- очаговые изменения в легких;
- крепитация при аускультации;
- резкий цианоз;
- по результатам лабораторных и инструментальных исследований:
- очаговые или инфильтративные изменения на рентгенограмме органов грудной клетки;
- анемия;
- необратимость обструкции дыхательных путей;
- выраженная гипоксемия.
Следующие признаки весьма характерны для дебюта астмы:
- частые эпизоды БОС (чаще одного раза в месяц);
- кашель или одышка, появляющиеся при физической нагрузке;
- ночной кашель;
- кашель и одышка, повторяющиеся вне ОРВИ и не связанные с определенным сезоном;
- эпизоды БОС, сохраняющиеся у ребенка старше 3 лет.
Сочетание эпизодов БОС у ребенка в возрасте до трех лет и одного значимого фактора риска (наследственная отягощенность по астме или атопии) или двух менее значимых (эозинофилия, эпизоды шумного дыхания вне ОРВИ, аллергический ринит) предполагают наличие у ребенка астмы и возможность сохранения симптомов заболевания в более старшем возрасте. В настоящее время нет данных, что применение глюкокортикоидов способствует предотвращению развития астмы у детей из групп риска.
У детей старше пяти лет помочь в дифференциальной диагностике может исследование функции внешнего дыхания, а также оценка реакция на терапию бронходиллятаторами, глюкокортикостероидами и элиминационные мероприятия.
5.15. Бронхиальная астма и инфекция
Инфекции верхних и нижних дыхательных путей могут способствовать возникновению астмы и приводить к обострению заболевания. Респираторные инфекции у детей поражают эпителий дыхательных путей, способствуют гиперпродукции IgE, развитию гиперреактивности бронхов и сенсибилизации организма к неинфекционным аллергенам.
Доказано, что вирусная инфекция (RSV, риновирус, вирус гриппа и парагриппа, метапневмовирус) может вызывать бронхообструктивный синдром (БОС) у детей младшего возраста, но не ясно, является ли в этом случае БОС следствием особенностей бронхиального дерева маленьких детей или первым признаком астмы.
Некоторые виды вирусной инфекции чаще выявляются у детей младшего возраста с БОС, другие — у детей более старшего возраста. Так, при БОС RSV выявлялся у 68% детей младше года и только у 6% более старшего возраста. Риновирус выявляли у 41% детей младше года и у 71% более старшего возраста, причем БОС чаще выявлялся у детей с сочетанием риновирусной инфекции и атопии. Тяжелый, требующий госпитализации RSV бронхиолит, перенесенный в раннем возрасте, является фактором риска развития бронхиальной астмы у подростков. В некоторых исследованиях отмечается, что у 40% детей, перенесших RSV, в дальнейшем формируется бронхиальная астма.
Вместе с тем у детей, перенесших пневмонию или синдром крупа с признаками БОС, в подростковом периоде чаще отмечаются симптомы бронхиальной астмы, чем у сверстников.
С другой стороны, опубликованы наблюдения, что перенесенные в раннем возрасте инфекции, например корь, могут снизить риск развития бронхиальной астмы.
Утяжелению течения и развитию обострения бронхиальной астмы у детей могут способствовать аденоидные вегетации и аденоидит, в том числе в сочетании с аллергическим ринитом (риносинуситом). Большое значение имеют постназальный затек воспалительного отделяемого в нижние дыхательные пути и рино-бронхиальный рефлекс. Аденоидиты провоцируют длительный кашель, усиливают бронхиальную гиперреактивность, обструкцию дыхательных путей, замедляют ее регресс, иногда симулируют обострение бронхиальной астмы.
Медикаментозное лечение аденоидита должно быть индивидуальным и включает в себя элиминационную, ирригационную, антимикробную, противовирусную, противовоспалительную (противоаллергическую) терапию. Для лечения всех форм нарушения функции носоглоточной миндалины применяются интраназальные глюкокортикостероиды. Хирургические вмешательства (аденотомии) могут быть показаны в случае неэффективности комплексной комбинированной терапии.
Полагают, что факторами риска для появления повторных эпизодов БОС у детей младшего возраста являются недоношенность, курение матери во время беременности и сниженный INF-γ-ответ у ребенка младшего возраста.
Перенесенные паразитарные инфекции не предотвращают развитие астмы.
Недавно проведенные исследования у детей и взрослых предполагают, что не только вирусные инфекции, но и инфекции, вызванные Mycoplasma и Chlamydia, могут приводить к обострению, усугублять течение заболевания.
В целом «гигиеническая теория», которая утверждает, что перенесенные в раннем возрасте инфекции способствуют снижению риска развития аллергии и бронхиальной астмы в настоящее время не подтверждается, так как на развитие астмы в дальнейшем влияют многочисленные факторы.
По-видимому, взаимосвязь между инфекцией и развитием астмы имеет более сложный характер, так как наличие атопии влияет на реакцию респираторной системы на вирусную инфекцию, вирусная инфекция может влиять на развитие сенсибилизации и решающее значение имеет одновременное воздействие вирусов и аллергенов на организм больного (GINA 2010).
Содержание:
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии


