| Новости | e-Образование | Врачебные Общества | Тематические группы | Библиотека | Медиатека | Мероприятия | Атлас |
Присоединяйтесь!
- Повышение квалификации
- Сертифицированное образование
- Актуальные статьи
- Обзоры и репортажи
- Клинические случаи
- Новости медицины
- Советы коллег
Сообщество: Педиатрическое Респираторное Общество
Глава 7. Программа ведения детей с бронхиальной астмой ключевые положения
Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика.»
Ключевые положения:
Программа ведения детей с БА предусматривает комплексный подход с назначением широкого круга мероприятий для достижения стойкой ремиссии и высокого качества жизни у всех пациентов вне зависимости от тяжести заболевания;
- основные направления программы при бронхиальной астме у детей включают:
- устранение воздействия причинных факторов (элиминация);
- разработка индивидуальных планов базисной противовоспалительной терапии;
- разработка индивидуальных планов купирования обострений;
- разработка плана реабилитации и диспансерного наблюдения;
- просвещение и обучение больных детей и членов семьи;
- профилактика прогрессирования заболевания;
- исходя из патогенеза бронхиальной астмы современная терапия направлена на устранение аллергического воспаления слизистой оболочки бронхов, уменьшение гиперреактивности бронхов, восстановление бронхиальной проходимости и предупреждение структурной перестройки стенки бронхов;
- несвоевременная диагностика и неадекватная терапия — основные причины тяжелого течения и летальности при бронхиальной астме;
- выбор лечения определяется тяжестью течения и периодом бронхиальной астмы, достижением контроля.
Однако в любом случае необходим индивидуальный подход в выборе средств и методов лечения;
- этиопатогенетическим методом лечения бронхиальной астмы является аллергенспецифическая иммунотерапия;
- при фармакотерапии бронхиальной астмы рекомендуется «ступенчатый» подход, который включает в себя увеличение или уменьшение объема терапии в зависимости от выраженности клинических симптомов;
- в комплексной терапии следует использовать немедикаментозные методы лечения, хотя эффективность некоторых из них дискуссионна и нуждается в дальнейшем изучении;
- успешное лечение бронхиальной астмы невозможно без установления партнерских, доверительных отношений между врачом, больным ребенком, его родителями и близкими.
7.1. Элиминационные мероприятия
Согласно современным представлениям элиминационные мероприятия должны быть индивидуальными для каждого больного, гибкими и экономически приемлемыми.
Пока нет достаточных доказательств для того, чтобы рекомендовать специфические экологические стратегии для предупреждения развития бронхиальной астмы (первичной профилактики), однако для пациентов с персистирующей бронхиальной астмой, у которых клинически предполагается роль аллергенов, в частности ингаляционных бытовых, необходимо:
- выявить анамнестически возможный спектр аллергенов, ухудшающих течение бронхиальной астмы;
- обследовать: кожные тесты или аллергенспецифические антитела (IgE).
В настоящее время получен более строгий уровень рекомендаций и доказательств того, что ограничение экспозиции к ингаляционным бытовым аллергенам может влиять на контроль бронхиальной астмы. Больше всего усилий следует тратить на создание гипоаллергенного быта в той комнате, где ребенок спит. Если ребенок делит комнату с родителями, требования по уходу за постельными принадлежностями распространяются и на постель родителей.
Мероприятия для уменьшения действия бытовых, клещевых аллергенов и аллергенов домашних животных:
- снижение влажности в жилых помещениях с помощью соответствующего оборудования, адекватная вентиляция жилища, обеспечивающая поддержание влажности в доме до 50% и ниже;
- регулярная стирка постельного белья (1–2 раза в неделю) при температуре 55–60 °C;
- использование чехлов из непроницаемых для клещей тканей;
- применение для уборки жилища вакуумных пылесосов;
- замена ковров и ковровых покрытий на легко моющиеся линолеум или паркет, гардин и занавесок в спальне на моющиеся жалюзи, мебели с тканевым покрытием на моющуюся кожаную или виниловую;
- устранение мягких игрушек из спальни, при необходимости их стирка в горячей воде 55–60 °C или замораживание в морозильной камере;
- уничтожение тараканов с помощью соответствующих инсектицидов;
- блокирование мест их обитания (шпаклевание трещин в стенах, потолках, полах);
- устранение доступа насекомых к остаткам пищи;
- мытье пола водой с детергентами для устранения загрязненности и аллергенов.
Современные противоаллергенные защитные чехлы изготавливаются из тонкой синтетической ткани сверхплотного плетения, благодаря чему полностью ограждают человека от аллергенов, находящихся в подушках, одеялах и матрацах. Чехлы хорошо «дышат» — пропускают воздух и влагу;
- проветривание помещений в те часы, когда концентрация пыльцы в воздухе наименьшая (например, вечером) и закрывание окон днем в пик поллинации;
- ношение солнцезащитных очков для уменьшения попадания пыльцы на слизистую глаз;
- исключение контактов с травой, сеном, участия в сезонных сельхозработах;
- проведение в квартире ежедневной влажной уборки;
- ограничить прогулки в жаркую, сухую, ветреную погоду. Не выезжать в такую погоду в парк, поле, лес. Наилучшее время прогулки — после дождя;
- придя домой с улицы, вымыть не только руки, но и лицо. Для умывания можно использовать только водопроводную воду. На поверхности водоемов и открытых емкостей с водой осаждается много пыльцы;
- ежедневно вечером мыть голову и менять полотенце;
- исключение из питания пищевых продуктов с перекрестной аллергенной реактивностью;
- отказ от использования для лечения фитопрепаратов, от применения растительных косметических средств (мыло, шампуни, кремы, бальзамы и т. п.).
- если возможно, найти для домашнего животного другого владельца и не заводить новых домашних животных;
- после удаления животного из квартиры провести неоднократную тщательную уборку помещения для полного удаления следов слюны, экскрементов, перхоти, шерсти животного. Обычно симптомы бронхиальной астмы исчезают через 6 месяцев после того, как из дома удаляют любых домашних животных, которые могли быть источником аллергена, спровоцировавшего развитие заболевания;
- не допускать животное в спальную комнату и, если возможно, содержать животное вне дома;
- ковры, матрацы, покрытия подвергать регулярной вакуумной чистке;
- не посещать цирк, зоопарк и дома, где есть животные;
- не пользоваться одеждой из шерсти, меха животных;
- использовать фильтры высокоэффективной очистки; использовать осушители воздуха для помещений с повышенной (более 50–60%) влажностью;
- хранить книги, одежду, постельное белье только в закрытых шкафах. Несезонную одежду и обувь, неиспользуемые игрушки можно упаковать в полиэтилен;
- ее держать много комнатных растений — в цветочных горшках размножаются плесневые грибы, что является источником грибковых аллергенов. Регулярно пересаживать цветы в свежий грунт;
- использовать обогреватели, кондиционеры, вентиляторы для создания оптимальной влажности;
- использовать противогрибковые средства для обработки поверхностей в ванной комнате и других помещениях для уничтожения грибов;
- заменить ковровые покрытия и обои на легко моющиеся материалы;
- незамедлительно устранять любые протечки воды в доме для предотвращения высокой влажности и появления пятен плесени;
- не принимать участие в садовых работах осенью и весной, так как лежалые листья и трава служат источником плесневых грибков в воздухе;
- устранять активное и пассивное курение;
- проводить адекватную вентиляцию и применять вытяжные устройства, позволяющие снизить концентрацию оксида и диоксида азота, оксида и диоксида углерода, бытовых аэрозолей;
- не проводить ремонт помещений в присутствии детей;
- в периоды особо интенсивного загрязнения атмосферного воздуха (смог) в результате погодных и атмосферных условий стремиться оставаться дома в чистом, хорошо кондиционируемом помещении.
Мероприятия по снижению пищевой аллергии:
Пищевые продукты как триггеры бронхиальной астмы могут быть актуальными в группе детей раннего возраста или у больных с пыльцевой сенсибилизацией.
Подлежат полному исключению из применения лекарственные препараты, в особенности аспирин и другие нестероидные противовоспалительные средства, в связи с их способностью запускать особые механизмы аллергии, которые могут привести к тяжелым и жизнеугрожающим обострениям бронхиальной астмы (см. главу 5). Важным является анамнестическое выявление аллергии на антибиотики с последующим исключением этой группы препаратов ввиду угрозы развития анафилактических реакций. Консерванты, красители, ароматизаторы, стабилизаторы и лекарства, которые присутствуют в пищевых продуктах, вызывают тяжелые обострения бронхиальной астмы; поэтому такие продукты должны быть исключены из рациона пациентов с повышенной чувствительностью к ним.
Рекомендуется полностью избегать тех пищевых продуктов, роль которых доказана клинически и результатами аллергологического обследования в развитии бронхиальной обструкции. Ограничиваются газированные напитки, консервы, жевательные резинки и прочие «лакомства», содержащие различные эссенции, красители, консерванты, эмульгаторы. У детей с пыльцевой аллергией часто встречается непереносимость мёда, ряда фруктов и овощей. В указанных ситуациях ребенок должен получать индивидуально составленную с помощью специалиста диету. Важная цель при разработке диеты — не только выявить и исключить продукты, провоцирующие обострения, но и обеспечить ребенку полноценное и разнообразное питание.
7.2. Фармакотерапия
Задачей лечения БА является достижение ремиссии заболевания и предупреждение возникновения обострений. Фармакологические препараты делятся на средства базисной (противовоспалительной) терапии и средства неотложной помощи.
7.2.1. Пути введения лекарственных средств у детей
Широкое распространение ингаляционных устройств обусловлено преимуществами, которые связаны с доставкой препарата непосредственно в орган-мишень — органы дыхания:
- быстрое начало действия лекарственного средства;
- уменьшение общей дозы препарата при создании высоких концентраций лекарственного вещества в легких;
- минимализация риска системных побочных эффектов;
- отсутствие влияния на эффективность лечения возможных возрастных и индивидуальных различий в активности печеночного метаболизма.
В то же время ингаляционный метод доставки препаратов имеет ряд особенностей и ограничений:
- не все группы лекарственных средств могут доставляться ингаляционно (например, теофилины, антагонисты лейкотриенов). Таблетированные препараты имеют существенные положительные стороны;
- более низкий комплайнс у некоторых детей по сравнению с пероральным и парентеральным путями введения препаратов;
- индивидуальный подход к подбору ингаляционного устройства и обучение пациентов и родителей, и постоянный контроль техники ингаляции позволяют устранить большинство неудобств;
- возможность местных побочных эффектов;
- трудности воспроизведения корректной техники ингаляции при выраженной одышке.
Некоторые лекарственные препараты для лечения БА могут применяться только путем ингаляции, так как при приеме внутрь они не всасываются (например, антихолинэргические средства, кромоны). Ингаляционный путь доставки возможен для ингаляционных ГКС, β2-агонистов и антихолинергических препаратов, ряда муколитиков и антибиотиков.
При подборе ингаляционных систем доставки необходимо учитывать следующие факторы, влияющие на эффективную доставку лекарства из ингалятора в легкие:
- цель ингаляционной терапии;
- параметры, характеризующие систему доставки;
- техника ингаляции;
- возрастные и психологические характеристики пациента.
Уровень проникновения ингалируемых частиц препарата в дыхательные пути в зависимости от размера частиц
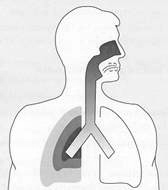 Носоглотка > 10 мкм
Носоглотка > 10 мкм- Трахея > 10 мкм
- Бронхи < 5 мкм
- Бронхиолы, альвеолы < 1 мкм
- < 0,5 мкм — остаются взвешенными в воздухе и выдыхаются
Терапевтический эффект при бронхиальной астме связывают с действием частиц размером в диапазоне 2–5 мкм, попадающих в бронхи. Более мелкие частицы (менее 0,5–0,8 мкм) в основном выдыхаются или достигают альвеол и, абсорбируясь, попадают в системный кровоток, увеличивая тем самым суммарную биодоступность препарата. Ингаляционные системы, создающие респирабельную фракцию частиц размером 2–5 мкм, являются оптимальными для попадания в мелкие бронхи.
Одним из основных параметров эффективности ингаляционного устройства является легочная депозиция (ЛД) — отношение дозы препарата, поступившей в легкие, к номинальной разовой дозе (указанной на ингаляторе). Современные технические средства обеспечивают доставку в легкие в среднем 5–15% номинальной дозы препарата, а у некоторых ПИ респирабельная фракция частиц может достигать 35%, и при этом процент коррелирует с клинической эффективностью. Поэтому эффективность лечения во многом определяется правильным выбором средства доставки с учетом возраста, индивидуальных предпочтений больного, а также клинической картины заболевания.
У детей применяют три типа устройств:
- дозированные аэрозольные ингаляторы (ДАИ);
- порошковые ингаляторы (ПИ);
- небулайзеры.
Рекомендации по выбору ингаляционного устройства у детей суммированы в табл. 7.1.
Таблица 7.1. Выбор средств доставки в зависимости от возраста
| Ингаляционное устройство | До 4 лет | 4–6 лет | 7 лет и старше |
|---|---|---|---|
| Небулайзер | + | + | + |
| ДАИ + спейсер небольшого объема | + | ||
| ДАИ + спейсер большого объема (750 мл) | + | + | |
| ПИ | + | + | |
| ДАИ | + |
Дозированный аэрозольные ингаляторы (ДАИ) — наиболее широко используемые устройства для ингаляционного введения препаратов. В настоящее время широкое распространение получили безфреоновые ДАИ, в которых в качестве пропеллента применяется гидрофторалкан (HFA). Они отличаются продукцией аэрозольных частиц меньшего среднего диаметра и меньшей скоростью потока аэрозоля на выходе из ингалятора, что обеспечивает большую степень легочной депозиции частиц (до 35% от доставленной дозы), по сравнению с традиционными аэрозолями на основе фреона (5–15% от доставленной дозы).
Во многих современных ингаляторах активное вещество содержится в виде суспензии, благодаря этому нет необходимости встряхивать баллончик с аэрозолем перед ингаляцией.
При использовании ДАИ требуется синхронизация между нажатием на баллончик, который выбрасывает аэрозоль, и вдохом ребенка. Вдох при использовании ДАИ должен быть как можно медленнее (продолжаться около 2–3 секунд у детей младшего возраста и 4–5 секунд у подростков) и максимально глубоким.
Задержка дыхания после вдоха необходима для того, чтобы мелкие частицы аэрозоля могли осаждаться на поверхности дыхательных путей. Каждая доза аэрозоля высвобождается из ингалятора всего за 0,1–0,2 с. Поэтому несинхронная преждевременная активация ингалятора (до начала вдоха) или преждевременный вдох существенно влияют на степень легочной депозиции препарата.
При использовании ДАИ больной должен быть тщательно обучен технике ингаляции с последующим контролем при повторных визитах. Для решения проблемы синхронизации маневра вдоха и ингаляции предложены ДАИ, активируемые вдохом. Минимальная скорость вдоха, необходимая для активации устройства, и простая техника ингаляции позволяют применять ингалятор «Легкое Дыхание» у детей с трехлетнего возраста даже при тяжелой обструкции дыхательных путей.
Для предотвращения технических ошибок рекомендуют применение у детей ДАИ со спейсером, что снижает оседание препаратов на слизистой оболочке полости рта и глотки, улучшает доставку в легкие, снижает местные и системные побочные эффекты. Спейсер с лицевой маской может применяться для ингаляций у детей с первых месяцев жизни.
Желательно использовать спейсеры с антистатическим покрытием.
При назначении препаратов через спейсер уровень легочной депозиции может существенно варьировать от 0,3 до 1,5% у детей от 9 мес. до 3 лет. В качестве альтернативы обычному спейсеру предложен вариант в виде Джет-системы. Джет-система, представляющая компактный спейсер с вихревым потоком частиц, позволяет решить вопрос синхронизации вдоха и активации ингалятора и не требует усилий даже у пациентов с выраженной бронхиальной обструкцией. Данный тип устройства может быть использован у детей с 12лет.
Дозированные порошковые ингаляторы (ДПИ)
Все порошковые ингаляторы (ПИ) относятся к устройствам пассивного типа, т. е. выделение препарата в них происходит под воздействием потока воздуха, создаваемого вдохом больного. ПИ не требуют координации вдоха.
Вдох через ПИ должен быть быстрым, энергичным, что улучшает доставку препарата.
Виды ПИ: Турбухалер — с 6 лет, Мультидиск — с 4 лет, Твистхейлер — с 12 лет (для России; в США и странах Европы — с 4 лет).
ДПИ имеют 2 основных принципа дозирования: предварительно отмеренный, когда каждая доза индивидуально отмерена производителем (Мультидиск — мультидозированный, Аэролайзер — одноразовый и т.д.), и резервуарный, когда весь объем лекарства находится в контейнере, а дозирование осуществляется самим пациентом при подготовке ингалятора к использованию (Турбухалер). Использование Мультидиска обеспечивает постоянство дозы при различных значениях инспираторного потока (от 30 до 90 л/мин.), он может легко использоваться у пациентов с любой степенью тяжести заболевания и у детей.
Небулайзер
Небулайзер — универсальная система для ингаляции лекарств у детей любого возраста, так как не требует специальной техники вдоха и применяется даже у новорожденных. Для доставки противоастматических препаратов следует использовать струйные и мембранные небулайзеры. Современные струйные небулайзеры оснащены уникальной технологией виртуальных клапанов (VVT), которая может оптимизировать воздушный поток для детей, способствует минимальным потерям лекарства во время ингаляции и упрощает дезинфекцию небулайзерной камеры. Новое поколение мембранных небулайзеров — идеальное решение для маленьких пациентов. Инновационная меш—технология не разрушает высокомолекулярные лекарства, ингаляции бесшумны, что дает возможность проведения процедуры даже во время сна малыша.
Небулайзер обязательно должен быть протестирован и сертифицирован в соответствии с Европейским стандартом по небулайзерной терапии prEN13544–1. (См. Приложение).
Небулайзерная ингаляция применяется как для поддерживающей терапии, так и для терапии обострений БА специально предназначенными для этой цели лекарственными формами: растворы и суспензии. С помощью небулайзеров можно использовать широкий спектр лекарственных средств (могут быть использованы все стандартные растворы для ингаляций) и их комбинаций (возможность одновременного применения двух и более лекарственных препаратов).
У детей первых лет жизни небулайзер обеспечивает более надежную доставку препарата в дыхательные пути по сравнению с ДАИ со спейсером благодаря простой технике ингаляции, возможности доставки большей дозы препарата и получения эффекта за более короткий промежуток времени.
Во время обострения доставка препаратов с помощью небулайзера предпочтительна у всех детей раннего возраста и у большинства детей других возрастных групп. У детей раннего возраста при этом необходимо использовать маску соответствующего размера. Небулайзерная терапия широко используется при лечении приступов бронхиальной астмы в условиях скорой помощи, в отделениях неотложной терапии и специализированных отделениях больниц. У детей раннего возраста небулайзер может быть использован и для длительной терапии (см. приложение).
Не рекомендуется использовать для небулайзеров все растворы, содержащие масла суспензии и растворы, содержащие взвешенные частицы, в том числе отвары и настои трав, растворы эуфиллина, папаверина, платифиллина, димедрола и им подобные средства, как не имеющие точек приложения на слизистой оболочке дыхательных путей.
7.2.2. Базисная (противовоспалительная) терапия
Ключевые положения:
- основой фармакотерапии бронхиальной астмы является базисная (профилактическая, или противовоспалительная) терапия, под которой понимают регулярное длительное применение препаратов, купирующих воспаление в слизистой оболочке дыхательных путей;
- базисная терапия назначается индивидуально, с учетом тяжести заболевания на момент осмотра больного; корригируется в зависимости от достигаемого эффекта и сопутствующих заболеваний;
- в клинической практике наиболее показательным эффектом лечения ИГКС является снижение частоты обострений и частоты госпитализаций;
- у детей старше шести лет базисная терапия проводится под контролем функции внешнего дыхания.
К препаратам базисной терапии относятся:
- ингаляционные глюкокортикостероиды (ИГКС);
- антагонисты лейкотриеновых рецепторов (АЛТР);
- β2-агонисты длительно действующие в комбинации с ингаляционными глюкокортикостероидами (β2-агонист ДД) (сами по себе противовоспалительным действием не обладают);
- кромоны (кромоглициевая кислота, недокромил натрия);
- теофиллины;
- моноклональные антитела к IgE;
- системные глюкокортикостероиды;
- аллергенспецифическая иммунотерапия (АСИТ).
Объем базисной терапии определяется тяжестью и уровнем контроля бронхиальной астмы, возрастом больных детей, характером сопутствующей патологии.
Воспалительный процесс в бронхах выявляется не только во время обострения, но и в фазе ремиссии, в связи с чем необходимым является длительное применение противовоспалительных препаратов для профилактики обострений бронхиальной астмы.
Таблица 7.2. Сравнительные эквипотентные суточные дозы (мкг) ИГКС для базисной терапии у детей до пяти лет (по GINA 2010)
| Препарат | Низкие/Средние дозы | Высокие дозы |
|---|---|---|
| Суспензия будесонида для небулайзерной ингаляции | 250–500 | >500 |
| Флутиказон ДАИ | 100–200 | >200 |
| Беклометазон ДАИ | 100–200 | >200 |
Глюкокортикостероиды
Ингаляционные глюкокортикостероиды (ИГКС) в настоящее время являются наиболее эффективными противовоспалительными препаратами для лечения БА и могут назначаться с 6 мес. (табл. 7.2, 7.3). Они способны подавлять как острое, так и хроническое воспаление. Уменьшение воспаления под воздействием ингаляционных глюкокортикостероидов в слизистой оболочке бронхов сопровождается уменьшением их гиперреактивности, снижением частоты обострений бронхиальной астмы, способствует достижению ремиссии, уменьшают смертность от БА.
Современные ИГКС (беклометазон дипропионат, будесонид, флутиказон пропионат, мометазона фуроат, циклесонид) отличаются по биодоступности и активности, оказывают минимальное общее воздействие. Результаты исследований свидетельствуют о необходимости длительного применения ИГКС при тяжелом течении (не менее 6–8 мес.), однако даже при длительной ремиссии после отмены ИГКС возможно возобновление симптомов заболевания.
Таблица 7.3. Сравнительные эквипотентные суточные дозы (мкг) ИГКС для базисной терапии у детей старше 5 лет (по GINA 2006, 2010)
| Препарат | Низкие дозы | Средние дозы | Высокие дозы | |||
|---|---|---|---|---|---|---|
| до 12 лет | старше 12 лет | до 12 лет | старше 12 лет | до 12 лет | старше 12 лет | |
| Беклометазон ДАИ Beclometasone dipropionate |
100–200 |
>200–400 |
>200–400 |
>400–600 |
>400 |
>600 |
| Будесонид ДПИ Budesonide |
100–200 |
>200–400 |
>200–400 |
>400–800 |
>400 |
>800 |
| Суспензия будесонида для небулайзерной ингаляции Budesonide suspension |
250–500 |
>500-1000 |
>500-1000 |
>1000-1500 |
>1000 |
>1500 |
| Флутиказон ДАИ Fluticasone propionate |
100–200 |
100–250 |
>200–500 |
>250–500 |
>500 |
>500 |
| Мометазона фуроат ДПИ Mometasone furoate |
100 |
200 |
>200 |
>200–400 |
>400 |
>400 |
| Циклесонид ДАИ Ciclesonide |
80–160 |
80–160 |
>160–320 |
>160–320 |
>320 |
>320 |
| Обозначения: ДПИ—дозированный порошковый ингалятор; ДАИ— дозированный аэрозольный ингалятор | ||||||
Начальная доза ИГКС назначается соответственно с тяжестью заболевания, и при достижении контроля доза снижается до минимальной поддерживающей. У детей любого возраста при правильно выбранном ингаляторе и соблюдении техники ингаляции симптомы БА и легочная функция быстро (через 1–2 недели) улучшаются на низких и средних дозах (т. е. эквивалентны 250–500 мкг будесонида ежедневно). Только небольшому числу детей требуются высокие дозы ИГКС. Например, курение уменьшает ответ на ИГКС, поэтому у курящих подростков могут потребоваться более высокие дозы гормонов или назначение ИГКС в комбинации с β2-агонистами ДД, АЛТР.
При отсутствии эффекта, сохранении симптомов, предпочтительна комбинация с другими классами контролирующей терапии (β2агонисты ДД, АЛТР), чем увеличение дозы ИГКС. Наблюдается взаимосвязь между дозой ИГКС и предотвращением тяжелых обострений. Недостаточно доказательств эффективности длительного использования низких доз ИГКС у детей раннего возраста для предотвращения обструкции бронхов, вызванной респираторной инфекцией.
Беклометазон — ИГКС с высокой местной противовоспалительной активностью. Беклометазон выпускается в дозированном аэрозольном ингаляторе (бекотид, беклазон Эко, кленил, кленил джет) и дозированном аэрозольном ингаляторе, активируемом вдохом (беклазон Эко «Легкое Дыхание»), по 50, 100 и 250 мкг препарата в одной дозе. Беклометазон практически не обладает минералокортикоидной активностью и не оказывает заметного резорбтивного действия после ингаляционного и интраназального применения. Терапевтический эффект развивается обычно через 5–7 дней терапии. При ингаляции 10–20% дозы поступает в легкие, где происходит гидролиз беклометазона дипропионата в его активный метаболит — беклометазона монопропионат. Большая часть препарата, попавшая в желудочно-кишечный тракт, метаболизируется при первом прохождении через печень. Период полувыведения 15 часов. Большая часть препарата (35–76%, вне зависимости от пути введения) выводится в течение 96 часов с калом, 10% — с мочой. У детей назначается с возраста 4 лет 2–4 раза в сутки.
Побочные эффекты редки и сходны с другими ИГКС: охриплость голоса, ощущение раздражения в горле, кашель и чихание, редко — парадоксальный бронхоспазм, легко устраняемый предварительным применением бронходилататоров; кандидоз полости рта и верхних дыхательных путей, проходящий после местной противогрибковой терапии без прекращения лечения.
Будесонид — ИГКС, обладающий выраженной противовоспалительной активностью. Биодоступность будесонида составляет 10% от попавшей в кишечник фракции; около 28% всасывается из легких. От 85 до 90% будесонида в крови связывается с белками плазмы. Будесонид подвергается интенсивному метаболизму в печени, причем у детей этот процесс на 40% быстрее, чем у взрослых; при этом образуются неактивные метаболиты, выводящиеся из организма в основном с мочой.
Будесонид — ИГКС с возможным однократным назначением в сутки. Исследования дозозависимого эффекта при титровании дозы показывают быстрый клинический эффект и улучшение функциональных показателей на низких дозах будесонида.
Будесонид выпускается в виде порошка для ингаляций и суспензии. Средствами доставки для порошка будесонида являются Турбухалер и Новолайзер, применяются у детей с шести лет. Турбухалер содержит 100 или 200 мкг будесонида в одной ингалируемой дозе. Новолайзер имеет сменные картриджи, содержащие 200 доз по 200 мкг будесонида.
Будесонид в виде суспензии (пульмикорт суспензия) применяют для ингаляции с 6 месяцев с помощью небулайзера с мундштуком или маской. Суспензию будесонида используют у детей с 6-месячного возраста в дозе 250–500 мкг 1–2 раз/сут.
В систему кровообращения у детей попадает около 6% от назначенной дозы будесонида, что примерно в два раза меньше, чем у взрослых.
Низкий уровень будесонида, определяемый в кровотоке, в сочетании с высоким клиренсом на 1 кг массы и коротким периодом полувыведения позволяет использовать одинаковые дозы будесонида через небулайзер у детей дошкольного возраста и взрослых без повышения риска развития нежелательных побочных реакций. Длительное рандомизированное исследование, продолжавшееся около девяти лет, не выявило влияния непрерывного лечения будесонидом в дозе 400 мкг/сут на линейный рост детей, базальную концентрацию кортизола, а также концентрацию кортизола в плазме крови в ответ на стимуляцию с АКТГ.
Суспензия будесонида не передается через грудное молоко. У детей раннего возраста Пульмикорт суспензия может использоваться для лечения стенозирующего ларинготрахеита. При лечении бронхиальной обструкции через небулайзер суспензия будесонида может использоваться совместно с β2-агонистами КД и амброксолом.
Флутиказона пропионат — современный галогенизированый (фторированный) высоколипофильный ИГКС, обладающий в связи с этим высокой аффинностью к глюкокортикоидному рецептору, способностью быстро поступать и задерживаться в тканях дыхательных путей.
Флутиказона пропионат отличает благоприятное соотношение между глюкокортикоидной/противовоспалительной и минералокортикоидной активностью (высокая селективность), безопасен при длительном применении. Легочная абсорбция составляет 16%, а пероральная системная биодоступность <1%. Метаболизм в печени происходит при участии фермента СУРЗА4 системы цитохрома Р450. Период полувыведения 8 часов.
Высокий терапевтический индекс флутиказона пропионата при постоянном применении адекватно подобранных доз приводит к уменьшению клинической симптоматики, снижает потребность в быстродействующих бронходилататорах и частоту обострений.
Большое количество результатов клинических исследований у детей с 1 года жизни свидетельствует об отсутствии влияния на скорость роста и безопасность в отношении функционирования гипоталамо-гипофизарно-надпочечниковой системы длительной терапии флутиказона пропионатом в дозе до 200 мкг/сутки.
Флутиказона пропионат выпускается в виде ДАИ, не содержащего фреон, по 50, 125 и 250 мкг препарата в одной ингаляции для двукратного приема.
Мометазона фуроат — ИГКС, продемонстрировавший в исследованиях in vitro высокое сродство и способность к связыванию с ГКСрецепторами человека. Фармакокинетические свойства препарата позволяют проводить лечение астмы в режиме один раз в сутки, что повышает комплаентность пациентов, необходимую для достижения эффекта от терапии.
При ингаляционном применении препарат демонстрирует низкий уровень системной биодоступности (менее 1%). При применении в рекомендованных дозах концентрация препарата в плазме крови находилась на уровне или ниже предела количественного определения (50 пг/мл). В клинических исследованиях доказано, что часть мометазона фуроата, попадающая в ЖКТ в процессе ингаляции, полностью метаболизируется при первом прохождении через печень. Частота и спектр побочных эффектов сравнимы с таковыми для других ИГКС.
Мометазон выпускается в виде порошкового ингалятора, удобного в использовании. Препарат выпускается в двух дозировках по 200 и 400 мкг препарата в одной ингаляции. В зависимости от тяжести течения назначается детям старше 12 лет и взрослым 1 раз в сутки вечером, при тяжелых формах астмы максимальную суточную дозу 800 мкг рекомендуется разделять на два приема.
Циклесонид — является пролекарством, проявляет низкое сродство к глюкокортикостероидным рецепторам. После ингаляции циклесонид с помощью ферментов превращается в легких в активный метаболит дезциклесонид, который обладает выраженной противовоспалительной активностью и имеет в 100 раз большее сродство к ГК рецепторам по сравнению с циклесонидом. Внутри клеток дезциклесонид образует конъюгаты с длинноцепочечными жирными кислотами, которые отличаются высокой липофильностью, что позволяет воздавать внутриклеточное депо, способствует пролонгации противоспалительного эффекта и обеспечивает возможность назначения препарата 1 раз в день. Для циклесонида характерны: депозиция в периферических отделах легких до 55%, быстрый системный клиренс, незначительное содержание во внелегочных тканях, низкая пероральная биодоступность, высокий уровень связывания с белками (99%). Все это оказывает большое влияние на безопасность, снижает вероятность развития локальных (орофарингеальный кандидоз) и системных нежелательных реакций (подавление функции коры надпочечников, влияние на скорость линейного роста детей). Активный метаболит циклесонида метаболизируется до гидроксилированных неактивных метаболитов посредством катализа с участием изофермента CYP3A4.
У детей старше 6 лет рекомендована ежедневная доза 80–160 мкг однократно или 80 мкг дважды в день. Препарат может использоваться со спейсером или без него. Если использование спейсера необходимо, рекомендуется применять спейсер AeroChamberPlus. У детей старще 12 лет рекомендованная ежедневная доза составляет от 160 мкг до 640 мкг; дозу 640 мкг следует делить на два приема в день.
Побочные эффекты — большинство исследований, оценивающих системные эффекты ИГКС, проводились у детей старше 5 лет.
Рост и костная плотность
- Неконтролируемая или тяжелая астма оказывает негативное влияние на рост ребенка и окончательный рост взрослого.
- Замедление роста отмечается редко, при применении высоких доз любых ИГКС.
- Не получено статистически или клинически значительных отрицательных воздействий на рост детей при длительном использовании ИГКС в дозах 100–200 мкг в день.
- Дети в возрасте 4–10 лет более восприимчивы к воздействию ИГКС на рост, чем подростки.
- Изменения в темпе роста в течение первого года лечения, вызванные ИГКС, являются временными.
- Дети с астмой, получающие ИГКС, достигают нормального роста взрослого (с учетом наследственности), но в более позднем возрасте.
- Нет данных о статистически значимом увеличении риска переломов у детей, получающих ИГКС.
- При длительном или повторном назначении системных ГКС увеличивается риск перелома. Использование ИГКС уменьшает потребность в курсах системных ГКС.
- В длительных исследованиях, продолжительностью от 2 до 5 лет, не наблюдалось отрицательных воздействий лечения ИГКС на минеральную плотность костной ткани.
Гипоталамо-гипофизарно-адреналовая система
Хотя существуют различия между разными ИГКС и ингаляционными устройствами, лечение дозами ИГКС меньше чем 200 мкг будесонида или другими ИГКС в эквивалентной дозе обычно не сочетаются с супрессией ГГА системы у детей. В более высоких дозах минимальные изменения в функции надпочечников могут быть обнаружены только чувствительными методами. Есть единичные сообщения о надпочечниковой недостаточности у детей, получающих чрезмерно высокие дозы ИГКС.
Катаракта. Применение ИГКС не сопровождается повышением риска развития катаракты у детей.
Оральный кандидоз, дисфония. Оральный кандидоз при использовании ИГКС встречается редко. Спейсеры уменьшают риск возникновения орального кандидоза. Обязательно полоскание полости рта после ингаляции. Возникновение дисфонии или других значимых голосовых изменений во время лечения будесонидом сходно с плацебо. Лечение 500 мкг/с будесонида в течение 3–6 лет не влияло на увеличение уровня кариеса или крошения зубов.
Описано влияние на зубную эмаль с образованием эрозий, что может произойти из-за изменения pH ротовой полости после ингаляции β2-агонистов.
Другие местные побочные эффекты. Длительное использование ИГКС не сопровождается увеличением заболеваемости инфекциями нижних дыхательных путей, включая туберкулез.
Антагонисты лейкотриеновых рецепторов (АЛТР)
Антилейкотриеновые препараты (модификаторы лейкотриенов) включают антагонисты рецепторов цистеиниловых лейкотриенов 1 субтипа (монтелукаст, зафирлукаст) и ингибиторы 5-липооксигеназы (зилеутон — в России не зарегистрирован).
Антагонисты лейкотриеновых рецепторов (АЛТР) являются первой медиаторспецифической терапией бронхиальной астмы. Эффективность АЛТР доказана в рандомизированных клинических исследованиях у взрослых и детей с бронхиальной астмой. Они обладают противоспалительным действием и небольшим бронхолитическим эффектом тем самым снижают частоту обострений, улучшают функцию легких. Используются как монотерапия при легкой БА, в комбинации с другими видами базисной терапии — при более тяжелых формах заболевания.
Зафирлукаст — высокоселективный антагонист цистеиновых лейкотриеновых рецепторов — рекомендован для профилаткими приступов и для поддерживающей терапии БА у детей. В работах по сравнительной оценке зафирлукаста и других противоастмотических средств продемонстрирована эффективность препарата вравнимая с кромонами и низкими дозами ИГКС при легкой и среднетяжелой БА, а также при непереносимости аспирина, физической нагрузки и холодного воздуха.
Антагонист лейкотриеновых рецепторов (монтелукаст) улучшает симптомы бронхиальной астмы и обеспечивает бронхопротективное действие при бронхиальной астме у детей с двух лет. Монтелукаст рекомендован пациентам с БА и сопутствующим аллергическим ринитом, аллергический ринит также является зарегистрированным показанием. С позиции доказательной медицины антагонисты лейкотриеновых рецепторов назначают в качестве монотерапии детей с легкой бронхиальной астмой. Начало действия препарата может наблюдаться уже после приема первой дозы. Признаков развития толерантности снижения эффективности после 3,5 лет лечения в условиях клинических исследований не наблюдалось. Монтелукаст не используется для лечения острых приступов бронхиальной астмы.
Монтелукаст снижает частоту обострений бронхиальной астмы, обусловленных вирусной инфекцией. Наличие приступов бронхоспазма, спровоцированных ОРВИ у детей до 10 лет, считается предиктором корошего клинического эффекта на АЛТР. Монтелукаст предупреждает бронхоспазм, вызванный физической нагрузкой или холодным воздухом.
АЛТР обеспечивают отчетливый дополнительный терапевтический эффект при недостаточном контроле ИГКС у пациентов со среднетяжелой и тяжелой БА. При стабилизации состояния пациента возможно постепенное снижение дозы ИГКС под наблюдением врача.
Не рекомендуется резкая замена терапии ИГКС антагонистами лейкотриеновых рецепторов.
Показана эффективность антагонистов лейкотриеновых рецепторов у больных с непереносимостью аспирина и других нестероидных противовоспалительных средств.
В целом антагонисты лейкотриеновых рецепторов хорошо переносятся. Общая частота побочных эффектов, о которых сообщалось при применении монтелукаста, сопоставима с таковой для плацебо как в течение короткого, так и длительного периодов лечения.
В РФ зарегистрирован монтелукаст 4 мг у детей 2–5лет, 5 мг у детей 6–14 лет один раз в сутки, 10 мг у детей 15 лет и старше. Зафирлукаст используют у детей старше 12 лет в дозе 20 мг 2 раза в сутки; у детей 7–11 лет рекомендуется начинать лечение с дозы 10 мг два раза в сутки, поддерживающая доза — 10 мг 2 раза в сутки.
Ингаляционные β2-агонисты длительного действия
Ингаляционные β2-агонисты ДД включают формотерол и салметерол продолжительностью действия более 12 часов. Их фармакотерапевтическое действие связано со способностью расслаблять гладкую мускулатуру бронхов, усиливать мукоцилиарный транспорт. При длительном их применении отмечается небольшое противовоспалительное действие вследствие снижения сосудистой проницаемости, уменьшения выделения медиаторов из тучных клеток и базофилов, а также некоторое снижение бронхиальной гиперреактивности, недостаточное, чтобы использовать их в качестве монотерапии.
Формотерол — β2-агонист с фармакологическим эффектом, сочетающим как быстрое начало действия, так и его продолжительность. Время наступления бронхорасширяющего эффекта у формотерола и короткодействующих β2-агонистов сопоставимо (через 1–3 мин.), продолжительность действия формотерола составляет 12 часов. С учетом фармакологических свойств формотерол (Аэролайзер, Турбухалер) при необходимости может использоваться дополнительно к базисной терапии, что позволяет уменьшить частоту использования β2-агонистов короткого действия.
Формотерол обеспечивает бронхопротективное действие при физических нагрузках и может быть использован в однократной дозе при необходимости интенсивной физической нагрузки у детей (начиная с 5 лет) с нетяжелой бронхиальной астмой нестабильного течения, эффективно блокируя бронхоспазм на физическую нагрузку в течение нескольких часов.
Салметерол отличается высокой липофильностью, поэтому активно связывается с клеточной мембраной. Особенности механизма действия салметерола позволяют ему длительно воздействовать на β2-рецепторы (до 12 часов). В дозе 50 мкг салметерол вызывает расширение бронхов приблизительно через 15–20 мин. и используется с 4 лет в комбинации с ИГКС. Салметерол не используется у детей в дозе >100 мкг/сутки.
Эффективность β2-агонистов ДД не доказана у детей до 4 лет, и требуются дальнейшие исследования. Ингаляционные β2-агонисты ДД следует назначать перед повышением доз ИГКС в тех случаях, когда стандартные начальные дозы ИГКС не позволяют достичь контроля бронхиальной астмы. Введение в комплекс терапии больным с недостаточно контролируемой средними и высокими дозами ИГКС бронхиальной астмой β2-агонистов ДД является более предпочтительным, чем увеличение дозы ИГКС.
Побочные эффекты рекомендуемых доз β2-агонистов длительного и короткого действия сопоставимы. Формотерол хорошо переносится больными и по частоте нежелательных явлений практически не отличается от плацебо, при приеме у детей не отмечается увеличения АД, ЧСС, удлинения интервала QT.
ИГКС и β2-агонисты ДД обладают синергизмом действия, связанным с особенностями механизма их действия на клеточном и молекулярном уровнях: глюкокортикостероиды снижают десенситизацию и толерантность β2-рецепторов и повышают синтез β2-рецепторов в бронхах; β2-агонисты ДД через механизм фосфорилирования стимулируют неактивный глюкокортикостероидный рецептор, в результате чего он становится более чувствительным к стероидам. Благодаря этому терапия ИГКС в комбинации с β2-агонистом ДД имеет более высокую терапевтическую эффективность, оказывает более выраженное противовоспалительное и бронхорасширяющее действие по сравнению с монокомпонентами.
Осуществление этой терапии возможно в виде свободной или фиксированной комбинации ИГКС и β2-агониста ДД. Использование свободной комбинации позволяет индивидуально подобрать дозы каждого из компонентов терапии в соответствии с потребностями пациента. Фиксированная комбинация у детей предпочтительна, так как исключает возможность изолированной отмены ИГКС.
Будесонид + формотерол является комбинированным ингаляционным препаратом, в состав которого входят глюкокортикостероид будесонид и β2-агонист ДД формотерол. Препарат оказывает противовоспалительное действие в бронхах, снижает выраженность симптомов и частоту обострений бронхиальной астмы, снижает выраженность отека слизистой бронхов, продукцию слизи и гиперреактивность дыхательных путей, вызывает расслабление гладкой мускулатуры в течение 1–3 мин. после ингаляции с продолжительностью действия в течение 12 часов.
Препарат выпускается в виде порошкового ингалятора Турбухалер, каждая доставленная доза которого содержит 160 мкг будесонида/4,5 мкг формотерола и 80 мкг будесонида/4,5 мкг формотерола. Препарат применяется у детей старше 6 лет по 1–2 ингаляции 1–2 раза в сутки. Бронхолитическое действие наступает быстро — в течение 1–3 мин. после ингаляции и сохраняется в течение 12 ч.
Рекомендации врача по использованию постоянной дозы препарата, так называемый фиксированный режим дозирования, не позволяют больному изменять дозу препарата без консультации с врачом. Поэтому при ухудшении или улучшении состояния, доза препарата и кратность применения должны быть скорректированы специалистом. Наличие у препарата различных дозировок и возможность использовать от 1 до 4 ингалляций в сутки, позволяют осуществить индивидуальный подбор дозы пациенту в зависимости от его самочувствия и уровня контроля астмы.
При гибком регулируемом режиме дозирования при ухудшении течения бронхиальной астмы доза того же препарата временно увеличивается, а при стабилизации состояния снижается до поддерживающей. Сочетание в одном ингаляторе будесонида и формотерола, обладающих выраженным противовоспалительным и длительным бронхорасширяющим эффектами, позволяют использовать эту комбинацию в качестве базисной терапии, и достигать контроля астмы меньшими дозами гормонов. Эффективность и безопасность комбинации будесонид + формотерол продемонстрированы в рандомизированных контролируемых исследованиях более чем у 10 000 взрослых и детей старше 6 лет с бронхиальной астмой различной степени тяжести.
Флутиказона пропионат + салметерол применяется у детей с четырех лет в качестве стартовой поддерживающей терапии у пациентов с персистирующей бронхиальной астмой для достижения контроля над заболеванием, позволяет приблизительно в 5 раз быстрее достичь контроля астмы по сравлению с монотерапией ИГКС, увеличивает приверженность пациентов к лечению, предотвращает обострения астмы, предупреждает формирование необратимых изменений в бронхиальной стенке. Регулярное применение комбинации флутиказон+салметерол предотвращает симптомы бронхиальной астмы и обеспечивает достижение контроля над бронхиальной астмой так же эффективно, как и вдвое большая доза ИГКС. Формы выпуска: порошковый ингалятор Мультидиск, каждая доза которого содержит 50 мкг салметерола ксинафоата в комбинации со 100, 250 или 500 мкг флутиказона пропионата; ДАИ, не содержащий фреон, каждая доза которого содержит 25 мкг салметерола ксинафоата в комбинации с 50, 125 или 250 мкг флутиказона пропионата.
Большая научно-практическая база с максимальным уровнем доказательности свидетельствует о высокой эффективности в режиме стабильного дозирования этой фиксированной комбинации. Постоянная базисная терапия флутиказона пропионата+салметерола по данным клинических исследований позволяет достигнуть контроля астмы согласно критериям GINA у 62–78% пациентов, в зависимости от анамнеза заболевания (в исследование включались дети с 12 лет).
Эффективность и безопасность комбинации флутиказона пропионата + салметерол продемонстрированы в рандомизированных контролируемых исследованиях более чем у 22 600 детей и взрослых с бронхиальной астмой различной степени тяжести.
Беклометазона дипропионат + формотерол — фиксированная комбинация экстрамелкодисперстного аэрозоля ИГКС с диаметром частиц 1,5 мкм и формотерола. Используется у детей старше 12 лет и взрослых для контролирующей терапии персистирующей БА, обеспечивая высокую эффективность при меньшей дозе ИГКС. Форма выпуска: ДАИ 100 мкг + 6 мкг формотерола в 4 дозе.
Бoльшая эффективность комбинированной терапии ведет к созданию других фиксированных комбинаций (мометазона фуроат + формотерол). В качестве альтернативы возможна комбинация ИГКС с медленно высвобождаемыми теофиллинами и антагонистами лейкотриеновых рецепторов.
Системные глюкокортикостероиды
Использование системных глюкокортикостероидов у детей с бронхиальной астмой показано при тяжелых или длительных обострениях, в основном короткими курсами (3–5 дней) (см. раздел «Обострения БА»). В этих случаях после достижения эффекта нет необходимости в постепенном снижении их дозы как перорально, так и парентерально. При необходимости длительного лечения предпочтение отдается пероральным глюкокортикостероидам ежедневно или через день с учетом суточного ритма. Лучше назначать такие пероральные глюкокортикостероиды, как преднизолон или метилпреднизолон, обладающие минимальным минералокортикоидным эффектом, относительно коротким периодом полувыведения и нерезко выраженным действием на поперечнополосатую мускулатуру. Назначение депонированных инъекционных глюкокортикостероидов не рекомендуется.
Кромоны
Кромогликат натрия (Sodium cromoglycate) — предотвращает развитие ранней и поздней фазы аллергенспровоцированной бронхообструкции, уменьшает бронхиальную гиперреактивность, предупреждает бронхоспазм, вызванный физической нагрузкой, холодным воздухом и диоксидом серы, предупреждает возникновение бронхоспазма в ответ на ингаляцию аллергена. Выпускается в виде дозированного аэрозоля в бронхи и в нос, раствора для небулайзера и глазных капель.
У детей раннего возраста дозированный ингалятор применяется со спейсером и лицевой маской. Раствор для ингаляции через небулайзер (20 мг) используется у детей c двух лет.
Кратность ингаляций 3–4 раза в день, продолжительность действия — 5 часов. Терапевтическое действие развивается постепенно, поэтому эффективность препарата оценивается через две недели от начала лечения. Одним из критериев тяжести астмы сегодня является интенсивность терапии для достижения контроля. Астма относится к легкой по тяжести у детей, у которых симптомы хорошо контролируются кромонами. Длительное использование кромонов показано для базисной терапии легкой БА у детей, а также для профилактики у них посленагрузочного бронхоспазма или перед контактом с аллергеном.
Кромоглициевая кислота хорошо переносится. Редкие побочные эффекты препарата у отдельных детей включают раздражение слизистой оболочки полости рта, верхних дыхательных путей, кашель, иногда бронхоспазм вследствие механического воздействия частиц препарата.
Недокромил натрия (Nedocromil sodium) — обладает антиаллергической противовоспалительной активностью, используется для базисной терапии легкой БА.
Недокромил натрия способен подавлять активацию и высвобождение медиаторов воспаления из эозинофилов, нейтрофилов, тучных клеток, моноцитов, макрофагов и тромбоцитов, что связано с влиянием препарата на хлоридные каналы клеточных мембран. Также предотвращает миграцию эозинофилов из сосудистого русла и ингибирует активность этих клеток, восстанавливает функциональную активность реснитчатых клеток, а именно биение ресничек, нарушенное в присутствии активированных эозинофилов. Ингибирует вызванный ингаляцией аллергена бронхоспазм, уменьшает неспецифическую гиперреактивность бронхов, предотвращает поздние аллергические реакции.
Препарат выпускается в форме дозированного аэрозоля для ингаляций. У взрослых и детей старше двух лет препарат применяют для профилактики обострения бронхиальной астмы в дозах от 2 мг (1 ингаляционная доза препарата) дважды в день до 4–8 мг 4 раза в сутки. Действие препарата следует оценивать через 2–4 недели от начала лечения.
Преимуществом использования кромонов в базисной терапии бронхиальной астмы у детей является высокий профиль безопасности этих препаратов.
Пролонгированные теофиллины используют в комплексе противовоспалительной терапии для предупреждения возникновения приступов бронхиальной астмы, особенно ночных. Получены доказательства способности теофиллина ингибировать активность фосфодиэстеразы в клетках, участвующих в развитии воспаления (тучных клетках легкого, альвеолярных макрофагах, Т-лимфоцитах, нейтрофилах, эозинофилах), что приводит к подавлению синтеза ими медиаторов воспаления, снижению провоспалительного потенциала этих клеток и торможению развития воспалительного инфильтрата, расслаблению гладкой мускулатуры бронхов. Полагают, что эффективность терапии теофиллином напрямую зависит от степени прироста а 2 -пуриновых рецепторов, препятствующих обусловленному аденозином высвобождению гистамина из тучных клеток. Под воздействием теофиллина увеличивается количество кортикостероидных рецепторов.
В ступенчатой терапии бронхиальной астмы у детей теофиллин рассматривается как монотерапия и как дополнение к ИГКС при их недостаточной эффективности, но менее эффективен, чем ДД β2-агонисты.
Назначения теофиллина следует избегать при лечении детей до 1 года вследствие медленного и чрезвычайно вариабельного клиренса. Оптимальной является доза теофиллина, обеспечивающая в сыворотке концентрацию, равную 5–10 мкг/мл (55–110 мкгмоль/л). В связи с узким терапевтическим индексом и вариабельностью метаболизма при подборе дозировки необходим мониторинг концентрации теофиллина в крови. Низкие дозы (5 мг/кг/день) обеспечивают противовоспалительный эффект, низкую частоту побочных эффектов и не требуют контроля концентрации в сыворотке крови. Назначаются дважды в день.
Побочные эффекты (особенно при высоких дозах >10 мг/кг/сут) включают жалобы со стороны желудочно-кишечного тракта, (тошнота, рвота, анорексия), нарушения ритма сердца (тахикардия), судороги, возбуждение. Токсичность повышается при сочетании с некоторыми препаратами (макролиды, циметидин).
Антитела к иммуноглобулину E (Анти-IgE) — связывают свободно циркулирующие IgE и предотвращают их взаимодействие с высокоаффинными рецепторами на поверхности тучных клеток и базофилов. Тем самым снижается уровень свободного IgE, который является пусковым фактором каскада аллергических реакций.
После однократного подкожного введения омализумаба всасывание происходит медленно, пик концентрации препарата в сыворотке крови достигается в среднем через 7–8 дней. Элиминация IgG включает деградацию в ретикулоэндотелиальной системе печени. Не выявлено специфического накопления омализумаба в каких-либо органах и тканях. У пациентов с бронхиальной астмой период полувыведения омализумаба из сыворотки составляет в среднем 26 дней.
Омализумаб применяется у детей старше шести лет с персистирующей атопической среднетяжелой и тяжелой БА, симптомы которой недостаточно контролируются применением ИГКС в дозах эквивалентных 200–500 мкг/день беклометазона дипропионата. Омализумаб назначается в виде регулярных подкожных инъекций 1 или 2 раза в месяц в зависимости от уровня общего IgE и массы тела пациента в соответствии со специальной таблицей.
Об улучшении контроля БА при применении омализумаба свидетельствует уменьшение частоты обострений, а также снижение потребности в препаратах неотложной помощи и ингаляционных ГКС, уменьшение частоты использования системных ГКС для купирования обострений по сравнению с плацебо. Препарат предназначен для длительной терапии. Оценку эффективности терапии следует проводить, по крайней мере, через 16 недель лечения.
Терапия омализумабом должна проводится только обученными специалистами. На сегодня отсутствуют тесты, которые могут быть рекомендованы для прогнозирования результатов терапии анти-IgE. Как и при использовании любых протеинсодержащих препаратов, могут возникать местные и системные аллергические реакции, включая анафилактические реакции. Наиболее часто побочные эффекты в виде болезненности, эритемы, отека, зуда в месте инъекции.
Аллергенспецифическая иммунотерапия (АСИТ)
Аллергенспецифическая иммунотерапия (АСИТ), как один из перспективных и бурно развивающихся методов, находит широкое применение в комплексном лечении бронхиальной астмы. Данный метод позволяет вводить больному в возрастающих концентрациях причинно-значимый аллерген (аллергены), ответственный за клинические проявления. С помощью АСИТ формируется иммунологическая толерантность, снижается способность аллергена запускать аллергическую реакцию.
Для АСИТ используются преимущественно водно-солевые экстракты аллергенов. Это лечебные аллергены пыльцы деревьев, злаковых и сорных трав, домашней пыли, клещей рода Dermatophagoides, плесени. В ряде случаев используют аллергены домашних животных (собак, кошек). Применяются также лечебные аллергены, модифицированные формальдегидом или глутаровым альдегидом, а также сорбированные на суспензии фосфата кальция.
Выбор лечебного аллергена осуществляется на основе сопоставления клинических симптомов с результатами специфической аллергологической диагностики: анамнез, кожные пробы или определение IgE антител к различным аллергенам.
Существуют различные методы АСИТ, отличающиеся по способу введения лечебного аллергена: подкожный, пероральный, сублингвальный. Наибольшее распространение получил подкожный способ введения аллергена. Во многих работах показана эффективность этого способа введения аллергена. Однако такой способ введения аллергена имеет определенные неудобства. В связи с этим у детей все чаще и чаще используются пероральный и сублингвальный метод введения лечебного аллергена.
В России разрешены для сублингвальной АСИТ стандартизованные аллергены: весенняя смесь ранняя (аллергены пыльцы деревьев); смесь трав (аллергены пыльцы луговых трав); осенняя смесь (аллергены пыльцы сорных трав); смесь клещей домашней пыли и смесь плесеней (грибковые аллергены).
Показания для проведения АСИТ:
- АСИТ проводится детям с доказанной IgE зависимой бронхиальной астмой и выявленной сенсибилизацией к определенным видам аллергенов;
- АСИТ проводится врачом-аллергологом, имеющим специальную подготовку;
- в дни проведения АСИТ у больного ребенка не должно быть клинических симптомов бронхиальной астмы и ОФВ1 должно быть >80% от должных величин;
- АСИТ можно проводить с 5-летнего возраста. После введения аллергена ребенок должен наблюдаться в течение 30 минут;
- перед проведением АСИТ подписывается информированное согласие родителями или пациентами старше 12 лет. Противопоказания для проведения АСИТ:
- обострение бронхиальной астмы;
- острые респираторные и другие инфекционные заболевания;
- сопутствующие заболевания в стадии декомпенсации (болезни почек, печени, сердца, сахарный диабет и другие эндокринологические нарушения).
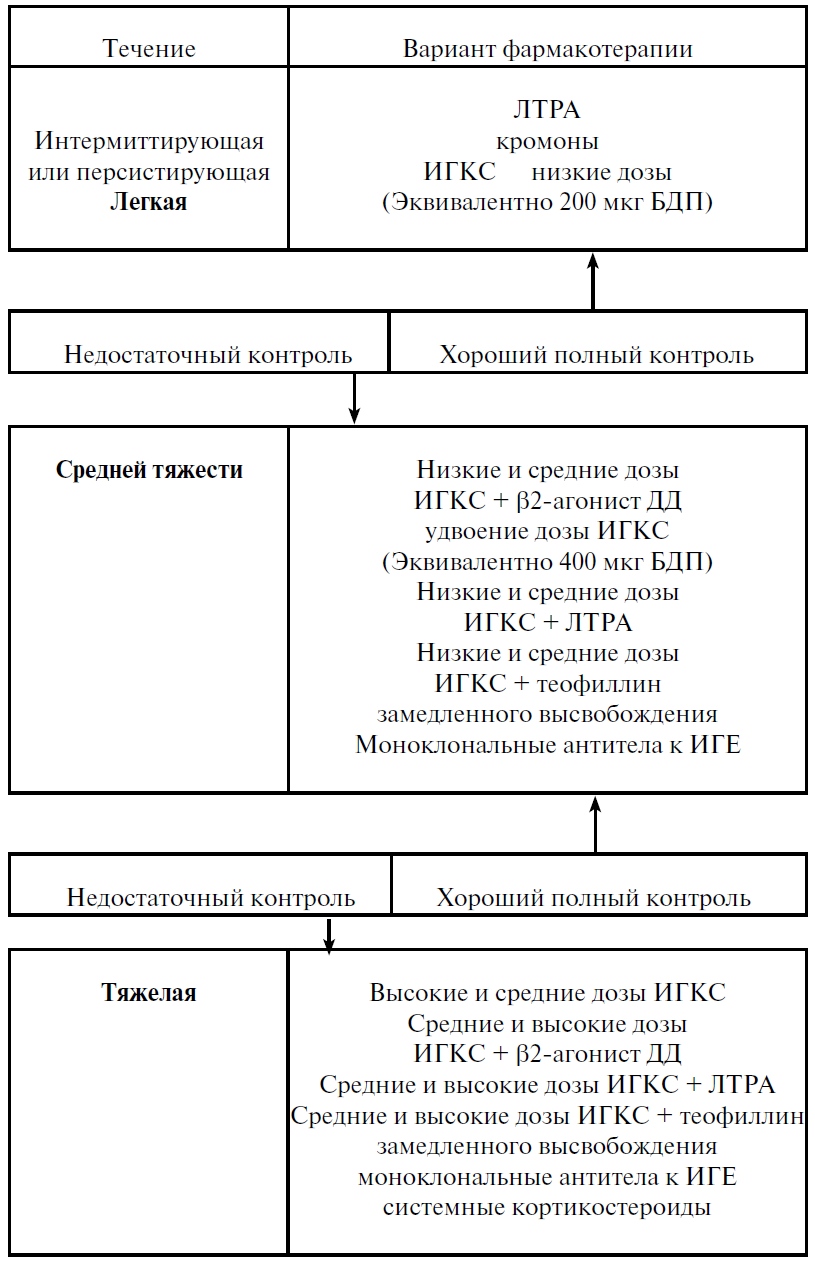
7.3. Алгоритм базисной фармакотерапии
Предлагается ступенчатый подход к терапии БА. Лечение назначается исходя из оценки тяжести заболевания, если пациент не получал терапии, и достигнутого результата, если пациент получает лечение (рис. 7.4.)
Рис. 7.4. Выбор или динамика базисной фармакотерапии у детей
Тактика при достижении контроля заболевания:
- каждые 3 мес. необходимо контролировать и проводить коррекцию терапии, поскольку при достижении терапевтического эффекта многие родители самостоятельно отменяют препараты базисной терапии, тем самым нарушается контроль за течением заболевания;
- препараты неотложной помощи (бронхолитики короткого действия) должны быть использованы при любой степени тяжести/контроля, если симптомы появляются/ухудшаются;
- при легкой БА используется один препарат. Если этого не достаточно — два лекарства. При средней или тяжелой астме необходимо увеличение дозы ИГКС, отдельно или в комбинации с другими препаратами.
Системные кортикостероиды используются у очень тяжелых больных. Омализумаб имеет специфические показания у детей при средне-тяжелой или тяжелой астме;
- прежде чем переходить на следующую ступень, всегда следует оценить приверженность к лечению, воздействие триггеров и альтернативные диагнозы. Предпочтения в выборе препаратов представлены в разделе 7.2.2;
- на всех ступенях проводятся занятия в астма-школах, дети обучаются дыхательным упражнениям, включаются в занятия спортом, прививаются навыки закаливания, используются методы климатотерапии, санаторное лечение, физические методы воздействия;
- при длительном использовании глюкокортикостероидов для профилактики побочных эффектов следует регулярно осматривать ротовую полость, измерять рост, АД и проводить денситометрию, осмотр окулиста, исследование функции надпочечников. Все пациенты и родители должны получить основную информацию о заболевании, проводимой терапии и необходимые навыки ингаляционной терапии и самомониторинга (см. раздел «Обучение»).
7.4. Алгоритм терапии обострений
В современной терапии обострений используется принцип сочетания бронхолитических и глюкокортикостероидных препаратов, оксигенотерапия.
Терапия, проводимая при обострении бронхиальной астмы, включает мероприятия, направленные на устранение бронхоспазма, уменьшение вазосекреторных расстройств, разжижение и удаление мокроты, ликвидацию дыхательной и сердечной недостаточности, гипоксии, метаболических нарушений и надпочечниковой недостаточности.
Целью лечения обострения является быстрое уменьшение (насколько возможно) обструкции бронхиального дерева и гипоксемии, а также предотвращение дальнейших рецидивов. Измерение пульса, частоты дыхания и анализ симптомов помогают в оценке эффективности проводимой терапии; важным является измерение функции внешнего дыхания, а в тяжелых случаях — пульсоксиметрия. Если у больного есть признаки ухудшения, он лечится в соответствии с более тяжелыми признаками.
Необходима разработка и выдача рекомендаций по индивидуальным планам лечения обострений.
Таблица 7.5. Основные группы бронхолитиков, применяемых при бронхиальной астме у детей
| Группа лекарственных средств | Действующие вещества (торговые названия) |
|---|---|
| Быстродействующие β2- агонисты | Короткодействующие: сальбутамол, фенотерол. |
| Длительнодействующие: формотерол, сальметерол, кленбутерол. | |
| Метилксантины | Теофиллин |
| Холинолитики | Ипратропия бромид |
| Комбинированные препараты | Фенотерол+Ипратропия бромид |
| Сальбутамол+Ипратропия бромид |
В терапии обострений бронхиальной астмы используют β2-агонисты, антихолинергические препараты, метилксантины (табл. 7.5).
Предпочтение по возможности следует отдать ингаляционным формам введения препаратов, позволяющим получить быстрый эффект и уменьшить общее воздействие на организм ребенка.
β2-агонисты — стимуляторы адренергических рецепторов при ингаляционном применении — дают быстрый, через 3–5 минут, бронходилатирующий эффект. Применяются в виде ДПИ, ДАИ, ДАИ со спейсером, растворов для распыления через небулайзер.
В зависимости от начала наступления эффекта β2-агонисты делятся на быстродействующие (1–3 мин.) и бронхолитики с медленным началом действия (20 мин); в зависимости от продолжительности действия — на бронхолитики короткого (4–6 час.) и длительного (более 8–12 час.) действия (табл. 7.6).
Таблица 7.6. Агонисты β2— адренергических рецепторов
| Начало действия | Длительность действия | |
|---|---|---|
| Короткое | Длительное | |
| Быстрое | Фенотерол Сальбутамол |
Формотерол |
| Медленное | Салметерол | |
Ингаляционные β2-агонисты назначаются в соответствии с алгоритмом в зависимости от тяжести обострения. При нетяжелых приступах бронхиальной астмы можно использовать короткодействующие β2-агонисты в ингаляционной и пероральной форме. Предпочтение отдается эпизодическому назначению. При увеличении частоты использования β2-агонистов более 3–4 раз в сутки необходим пересмотр и усиление базисной терапии.
При средней тяжести и тяжелом обострении бронхиальной астмы лучшим методом терапии и средством быстрой ликвидации бронхоконстрикции является повторное назначение β2-агонистов короткого действия. Синергетический эффект достигается добавлением к β2агонистам ипратропия бромида или использованием препаратов с фиксированной комбинацией β2-агонист/ипратропия бромид, хорошо зарекомендовавшей себя у детей, начиная с раннего возраста.
Сальбутамол — бронхорасширяющий эффект наступает через 3–5 мин и достигает максимума к 40–60-й минуте. Период полувыведения составляет 3–4 час., продолжительность действия — 4–5 час. Сальбутамол назначается детям старше 18 мес. с помощью ДАИ со спейсером по 100 мкг на ингаляцию, раствор сальбутамола сульфата назначается через небулайзер по 2,5 мл (1 небула — 2,5 мг) на ингаляцию в неразбавленном виде. Детям раннего возраста — в дозе 0,1–0,15 мг/ кг. В случаях умеренного проявления бронхиальной обструкции эффективны ингаляции сальбутамола с помощью ДАИ, активируемого вдохом («Легкое Дыхание»).
Фенотерол оказывает бронхолитический эффект через 3–5 мин. с максимумом действия к 20–40-й минуте. Период полувыведения составляет 3–4 час., а продолжительность действия — 5–6 час. С помощью ДАИ у детей старше 6 лет преимущественно используют фенотерол в дозе 100 мкг через небулайзер — 0,25–0,5 мл раствора фенотерола на ингаляцию. Если улучшение не наступает, проводят повторные ингаляции в той же дозе каждые 20 мин. в течение часа. Фенотерол в комбинации с ипратропия бромидом дает синергический бронхолитический эффект и может использоваться в возрастной дозировке на ингаляцию: 1кап. на кг до года, 10 кап. до 5 лет, 15–20 кап. старше 5 лет.
При применении β2-агонистов короткого действия возможны тремор рук, возбуждение, головная боль, компенсаторная тахикардия, нарушения ритма сердца, артериальная гипертензия. Нежелательные явления чаще встречаются у детей старших возрастных групп и подростков с заболеваниями сердечно-сосудистой системы, а также при неоднократном применении бронхоспазмолитиков. Частота и выраженность нежелательных эффектов зависят также от дозы и способа введения препарата.
β2-агонисты ДД с быстрым началом (формотерол) могут использоваться по необходимости при легкой бронхиальной астме, бронхоспазме на физическую нагрузку, для длительного регулярного приема — при среднетяжелой и тяжелой бронхиальной астме в сочетании с ИГКС. ДД β2-агонисты c медленным началом действия (салметерол) применяются для длительной комбинированной терапии в сочетании с ингаляционными глюкокортикостероидами.
Антихолинергические препараты. Ипратропиум бромид является блокатором М-холинорецепторов, ослабляет опосредованное ацетилхолином влияние парасимпатической вегетативной нервной системы и оказывает бронходилатирующее действие. Ипратропиум бромид характеризуется низкой растворимостью в жирах, плохо всасывается через биологические мембраны, поэтому терапевтический эффект при ингаляционном введении достигается за счет его местного воздействия.
Бронхоспазмолитический эффект ипратропиума бромида наступает через 5–15 мин. после ингаляции и достигает максимума в течение 1–1,5 час. Продолжительность клинического эффекта составляет 6–8 час. У детей раннего возраста с целью купирования острой обструкции легкой выраженности препарат может назначаться в виде монотерапии. Доза зависит от возраста ребенка. Для купирования обострения целесообразно проводить 2–3 ингаляции в сутки.
Комбинированные препараты. При бронхиальной астме для проведения неотложной помощи ипратропиум бромид используется в комбинации с β2-агонистами. Согласно международным рекомендациям GINA (2010) и Российской национальной программы «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2008) фиксированная комбинация фенотерола и ипратропиума бромида (Беродуал®) является первой линией терапии обострений, хорошо зарекомендовавшей себя у детей начиная с раннего возраста.
Фенотерол, действуя на β2-адренорецепторы, расслабляет гладкую мускулатуру бронхов, сосудов и противодействует развитию бронхоспастических реакций, обусловленных влиянием гистамина, метахолина, аллергенов, триггеров. Ипратропиум бромид воздействует на М-холинорецепторы. Под воздействием препарата происходит усиление мукоцилиарного транспорта. Метаанализ исследований сочетанного использования β2-агонистов + ипратропиума бромидами показывает их эффективность в снижении летальности и снижении частоты госпитализаций при обострении БА.
Для купирования обструкции ингаляции через небулайзер растворов беродуала проводят до 3–4 раза в день в адекватной возрасту ребенка дозе:
- новорожденные и дети грудного возраста — 1 капля/кг массы тела;
- до 6 лет (масса тела до 22 кг) из расчета 25 мкг ипратропия бромида и 50 мкг фенотерола на 1 кг — до 0,5 мл (10 капель) 3 раза в день;
- старше 6 лет — 0,5–1 мл (10–20 кап.) 3–4 раза в день.
Теофиллин относится к бронхолитикам, в низких дозах обладает умеренным противовоспалительным эффектом.
Теофиллин с замедленным высвобождением применяется 1–2 раза в день. Небольшое число доказательств для использования в качестве первой линии контролирующей терапии. Может применяться в комбинации с ИГКС при недостаточной эффективности монотерапии ИГКС.
Коротко действующие теофиллины обладают бронхоспазмолитической активностью и используются в целях купирования острых симптомов бронхиальной астмы в качестве дополнительной бронхолитической терапии. Препараты теофиллинового ряда короткого действия при приеме внутрь относительно быстро всасываются из желудочно-кишечного тракта; при этом максимальная их концентрация в крови достигается через 30–60 мин. после приема. Период полувыведения — 4–5 час.
При легких обострениях бронхиальной астмы назначение короткодействующих теофиллинов перорально может быть использовано для купирования возникших нарушений бронхиальной проходимости. У больных с тяжелым обострением бронхиальной астмы, резистентных к терапии β2-агонистами, и при астматическом состоянии инфузионная терапия эуфиллином используется в качестве дополнительного бронхолитического средства в комплексе проводимых лечебных мероприятий. Внутривенное введение эуфиллина позволяет быстро достичь высокой концентрации теофиллина в крови. Медленное внутривенное капельное введение эуфиллина при развитии тяжелого приступа бронхиальной астмы и астматического состояния позволяет предотвратить возникновение побочных явлений со стороны сердечно-сосудистой системы. Нагрузочная доза составляет 4,5–5 мг/кг в течение 20–30 мин.
В последующем эуфиллин может вводиться при непрерывной инфузии в дозе 0,6–1 мг/кг/ч или дробно в соответствующих дозах через каждые 4–5 час. под контролем концентрации теофиллина в крови, так как терапевтическая его концентрация колеблется в пределах 10–15 мкг/ мл (55–110 мкмоль/л). Из-за высокой вероятности побочных эффектов короткодействующие теофиллины сегодня используют в качестве альтернативной терапии и не назначаются у пациентов длительно применяющих теофиллин с замедленным высвобождением.
Побочные эффекты при лечении препаратами метилксантинового ряда (особенно в высоких дозах 10 мг/кг/день или более) включают симптомы со стороны ЦНС (раздражительность, беспокойство, головная боль, тремор, гиперестезия, судороги); со стороны желудочно-кишечного тракта (тошнота, рвота — наиболее частые ранние признаки, боли в животе). При использовании больших доз теофиллина может отмечаться учащение мочеиспускания, покраснение кожных покровов, субфебрилитет, при внутривенном введении эуфиллина, особенно при его форсированном введении, могут возникнуть симптомы со стороны сердечно-сосудистой системы (тахикардия, экстрасистолия, падение АД), которые могут угрожать жизни больного. Опасность развития побочных явлений при лечении препаратами метилксантинового ряда возникает при концентрации теофиллина в крови более 20 мкг/мл. Мониторинг концентрации препарата в плазме требуется при использовании высоких доз теофиллина или использовании препаратов, изменяющих его метаболизм (некоторые макролидные антибиотики, циметизин и др.), при использовании низких доз такой необходимости нет.
При бронхиальной обструкции с выраженными симптомами дыхательной недостаточности назначаются системные глюкокортикостероиды (внутрь или парентерально). Показанием к применению системных стероидов при острой обструкции являются:
- недостаточный эффект бронхолитиков (β2-агонистов или антихолинергических средств);
- тяжелые и жизнеугрожающие обострения;
- применение стероидов в анамнезе для купирования обострений.
Эти больные составляют группу риска по неблагоприятному исходу бронхиальной астмы. Больные, которые находятся в группе повышенного риска смерти от бронхиальной астмы, требуют особенно тщательного мониторинга и оказания быстрой помощи при развитии обострения заболевания. Терапевтический эффект системных стероидов при тяжелой обструкции сохраняется в течение 8–12 часов. Основные эффекты системных стероидов появляются через 4–6 час., поэтому при наличии показаний их следует включать в комплекс медикаментозной терапии на начальном этапе оказания неотложной помощи. При обострении БА используется доза 1 мг/кг массы в сутки (при пероральном введении), обеспечивающая контроль симптомов заболевания. При коротком курсе, после достижения позитивного эффекта терапии, препарат отменяется. Постепенного снижения дозы преднизолона не требуется. Длительность курса лечения обычно не превышает 3–5 дней. После отмены системных КС требуется продолжение лечения ИГКС.
Преднизолон внутрь назначают 1–2 раза в сутки из расчета 1–2 мг/кг/ сут. (детям до 1 года); 20 мг/сут. (детям 1–5 лет); 20–40 мг/сут. (детям старше 5 лет). При лечении детей с тяжелым обострением бронхиальной астмы может использоваться внутривенно метилпреднизолон от 60 до 125 мг каждые 6–8 ч, гидрокортизон (125–200 мг (4 мг/кг) каждые 6 час.).
Ингаляционные кортикостероиды(будесонид суспензия) являются стартовыми средствами и, как правило, включаются в комплекс бронхолитической терапии уже при среднетяжелом обострении. Представляет интерес использование пульмикорта суспензии как безопасной альтернативы терапии системными глюкокортикостероидами при обострении астмы у детей.
В одном из исследований показано, что применение тербуталина в комбинации c будесонидом у детей первых 18 мес. жизни с бронхообструктивным синдромом давало значительно больший эффект, чем один тербуталин или комбинация тербуталина и преднизолона внутрь. У больных в возрасте 7–13 лет c обострением тяжелой астмы введение будесонида в дозе 2 мг/сут. c помощью небулайзера по эффективности не уступало приему преднизолона в дозе 2 мг/кг внутрь.
При лечении обострений БА или купировании обструкции при инфекциях нижних дыхательных путей начальная доза суспензии пульмикорта составляет 0,5–1 мг 2 раза в день для детей от 3 месяцев до 12 лет и 1–2 мг 2 раза в сутки детей старше 12 лет. Начальная доза уменьшается до поддерживающей (как правило, на 50%) при достижении контроля за заболеванием. Исследования также показали эффективность назначения поддерживающей дозы суспензии пульмикорта 1 раз в день.
Пульмикорт-суспензию можно разбавлять физиологическим раствором, а также смешивать с растворами бронхолитиков (сальбутамол, ипратропия бромид, беродуал). Критерии оценки эффективности терапии обострений включают:
- хороший ответ — показатели ОФВ1 или ПСВ ≥ 80% от должного SaO2 ≥ 95%;
- неполный ответ и необходимость продолжать лечение — сохранение симптомов обструкции, тенденция к снижению показателя ПСВ, SaO2 ≥ 95%, но < 98%;
- о тяжелом обострении, требующем усиления терапии, свидетельствует отсутствие клинического эффекта от терапии, ОФВ1 и ПСВ ≤ 80%, SaO2 ≤ 95%.
Побочные эффекты при кратковременном курсе высокими дозами КС редки и включают обратимые изменения метаболизма глюкозы, повышение аппетита, задержку жидкости, увеличение веса, округление лица, повышение давления.
Сульфат магнезии через небулайзер или внутривенно может быть добавлен для улучшения проходимости дыхательных путей как разовое назначение при обострении и не рекомендуется для повседневной бронхолитической терапии, назначается у больных с тяжелым обострением астмы, которые получают максимальную ингаляционную бронхолитическую терапию и системные КС, и не дает адекватного ответа.
Однократно назначается доза 1,2–2 мг MgSO4 внутривенно в течение 20 мин. или 2,5 мг изотонического раствора MgSO4 (259 ммоль/л) через небулайзер. Исследования показывают, что сочетанное небулирование раствора сальбутамола в изотоническом растворе сульфата магния дает более выраженный бронхолитический эффект, нежели ингаляционная монотерапия сальбутамола (уровень доказательности А). Эффективность внутривенного введения сульфата магния при лечении обострений бронхиальной астмы у детей раннего возраста не изучалась.
В исключительных случаях для лечения анафилаксии и ангиоотека с тяжелым приступом БА показан п/к и в/м эпинефрин (адреналин) 5 мл 1: 10000 раствора внутривенно медленно; альтернативно 0,5 мл 1: 1000 (0,5 мг) раствора внутримышечно. Действие адреналина в малых и средних дозах начинается через 15–20 мин и длится 1–2 час.
Гелий-кислородная терапия. Систематический обзор исследований, которые оценивали влияние комбинации гелия и кислорода по сравнению с одним гелием, не выявил достоверных преимуществ этого вмешательства. Однако гелий-кислородная терапия может быть рассмотрена в качестве альтернативного метода при лечении пациентов, которые не отвечают на стандартную терапию.
Антагонисты лейкотриеновых рецепторов. Существует мало данных по исследованию их роли в терапии обострений БА.
Показания для госпитализации детей, больных бронхиальной астмой. При обострении бронхиальной астмы у детей направление на стационарное лечение показано при следующих ситуациях:
- невозможность или неэффективность (в течение 1–3 час.) лечения в домашних условиях;
- выраженная тяжесть состояния больного;
- детям из группы высокого риска осложнений и при необходимости установления природы обострений и подбора средств терапии при впервые возникших приступах удушья.
При оказании помощи детям с тяжелым обострением БА особое внимание следует уделять пациентам, имеющим факторы риска неблагоприятного исхода:
- тяжелое течение БА с частыми обострениями;
- наличие астматических состояний в анамнезе, особенно в течение последнего года;
- более двух обращений за медицинской помощью в последние сутки или более трех в течение 48 час;
- неконтролируемое течение БА;
- ранний или подростковый возраст ребенка;
- сочетание БА с эпилепсией, сахарным диабетом;
- несоблюдение врачебных рекомендаций и назначений родителями или пациентом;
- низкий социальный, культурный и экономический уровень.
Лечение обострений проводиться на фоне оксигенотерапии для поддержания адекватного уровня SaO2 (у детей более 92%). Кислород подается при помощи носовых канюль, маски или кислородной палатки. Регидратационная терапия необходима при развитии дегидрации вследствие увеличения частоты дыхания и уменьшения приема жидкости.
В качестве базисных растворов при проведении инфузионной терапии используется изотонический раствор натрия хлорида и 5%-ный раствор глюкозы (взятые поровну). Количество внутривенно вводимой жидкости у детей раннего возраста в зависимости от варианта периода обострения составляет 20–10 мл/кг массы, а общий объем — 150– 300 мл; скорость введения — 12–14 капель/мин., длительность инфузии в зависимости от объема — 3–6 час.
Обострение бронхиальной астмы на фоне ОРЗ
Респираторные инфекции (преимущественно вирусы, редко бактерии) нередко провоцируют обострения бронхиальной астмы. Респираторно-синцитиальный вирус, риновирус — наиболее частая причина бронхообструкции у детей первых месяцев жизни и триггеры ухудшения БА. Также могут провоцировать обострение аденовирусы, парагрипп, коронавирус. У некоторых пациентов повышен риск заболеваний, вызываемых пневмококком. Вирусная инфекция является адъювантом воспалительного ответа у детей с БА. Механизмы, участвующие в возникновении обструкции, включают повреждения респираторного эпителия, повышение бронхиальной гиперреактивности, стимуляцию вирус-специфических IgE-антител, увеличение выделения медиаторов и появление ответа на ингаляционные антигены.
Применяют симптоматическую терапию: при наличии лихорадки >38,5 °C используют жаропонижающие препараты (ибупрофен, парацетамол) под контролем.
Используют общие принципы терапии обострений: назначают β2агонисты КД (у детей раннего возраста через небулайзер фенотерол + ипратропия бромид, сальбутамол, сальбутамол+ипратропия бромид); при нетяжелых проявлениях бронхообструкции могут быть назначены β2-агонисты КД per os. При первом появлении симптомов респираторной инфекции возобновляют терапию ИГКС (если на данный момент ребенок их не получает) или увеличивают дозу в 1,5–2 раза и кратность введения. В раннем возрасте используют ингаляции будесонида через небулайзер. Если больной получал комбинированный препарат, включающий ИГКС и β2-агонисты ДД (будесонид/формотерол), его дозу временно увеличивают в 2 раза. В тяжелых случаях назначают системные ГКС. Терапию ИГКС следует начинать максимально рано, не дожидаясь появления свистящих хрипов. Показано, что при использовании ИГКС больные реже обращались за неотложной помощью и госпитализировались. Противовоспалительная терапия продолжается до достижения полного контроля.
Рис. 7.2. Терапия обострений бронхиальной астмы (на догоспитальном этапе, в отделении неотложной терапии и специализированном отделении больницы)
Эффективны в предотвращении вирус-индуцированных обострений БА антагонисты лейкотриеновых рецепторов.
Антибиотикотерапия назначается по общим принципам. Показания для антибактериальной терапии:
выраженные проявления бронхиальной обструкции, не поддающиеся противоастматической терапии, с явлениями токсикоза;
- стойкая гипертермия более 3 суток;
- появление мокроты гнойного характера;
- наличие клинико-рентгенологических признаков пневмонии;
- предполагаемая бактериальная этиология инфекции.
Особенности антибактериальной терапии у пациентов с бронхиальной астмой
При проведении антибактериальной терапии по поводу интеркуррентных инфекций у пациентов с бронхиальной астмой необходимо учитывать ряд важных особенностей, прежде всего:
- высокая вероятность развития аллергической реакции на антибиотик у пациентов с атопией, особенно в период обострения;
- вероятность лекарственного взаимодействия антибиотика и препаратов для лечения бронхиальной астмы и атопии.
Наиболее часто аллергические реакции вызывают b-лактамные антибиотики и сульфаниламиды (в том числе котримоксазол). Из b-лактамов чаще всего аллергию вызывают пенициллины. Необходимо отметить, что у пациентов с аллергией на пенициллины может развиваться перекрестная аллергия на другие b-лактамные антибиотики. Однако частота перекрестной аллергии для цефалоспоринов I поколения — 11%, для цефалоспоринов II поколения — 2%, для цефалоспоринов III поколения — менее 1%. У пациентов с документированной IgE-опосредованной реакцией на пенициллины могут быть использованы без ограничения цефалоспорины 3-го и 4-го поколения.
В настоящее время накоплены данные о связи патогенеза бронхиальной астмы с атипичными микроорганизмами — Chlamydophila pneumoniae и Mycoplasma pneumonia. Однако окончательная роль указанных возбудителей при бронхиальной астме не определена. Предполагается, что хроническое воспаление дыхательных путей, вызванное персистированием хламидий и микоплазм, увеличивает восприимчивость бронхов к аллергенам. Макролиды (кларитромицин, азитромицин, джозамицин, рокситромицин) — единственный класс антибиотиков, применение которых рекомендовано для лечения хламидийной и микоплазменной инфекции в педиатрии. Механизм положительного действия макролидов при БА остается неясным. Показан ряд противовоспалительных и иммуномодулирующих эффектов:
- уменьшение гиперреактивности бронхов за счет снижения образования эндотелина-1 и ингибирование нейромедиаторного сокращения мышц;
- снижение продукции слизи в бронхиальном дереве с увеличением подвижности ресничек мерцательного эпителия и мукоцилиарного клиренса;
- уменьшение выделения NO в результате ингибирования синтезы оксида азота как конститутивной (cNOS), так и индуцибельной (iNOS); ингибирование эластазы нейтрофилов, супероксидных анионов;
- стабилизация клеточной дегрануляции;
- угнетение продукции различных провоспалительных цитокинов и хемокинов — ИЛ-1b и ФНО- α в моноцитах, ИЛ-1b, ИЛ-6, ФНО- α, ГМ-КСФ в тучных клетках, ИЛ-8, нейтрофилактивирующего пептид78 (ENA78) и макрофагального воспалительного протеина-1 (MIP-1) в макрофагах и лейкоцитах, ИЛ-4 и ИЛ-5 в Т-лимфоцитах;
- снижение адгезии бактерий к эпителию, что тормозит формирование биопленок.
Стандартный курс лечения острых инфекций, вызванных атипичными бактериями составляет 10–14 дней. В кохрановском мета-анализе показано, что длительное применение (не менее 4 недель) макролидов (кларитромицин, рокситромицин и азитромицин) у пациентов с бронхиальной астмой может оказывать положительное влияние на течение заболевания.
Риносинуситы нередко сопутствуют БА. Необходимо выявление этиологии риносинусита. Антибиотикотерапия бактериального синусита уменьшает тяжесть БА. Могут быть использованы как системные, так и ингаляционные (флуимуцил антибиотик) антибиотики через небулайзер с пульсирующей подачей аэрозоля.
Муколитики. Показан положительный эффект дополнительного назначения амброксола в составе комплексной терапии детей с обострением БА, протекающим в виде обструктивного бронхита.
Другие виды лечения
Следует избегать назначения седативной терапии при обострении бронхиальной астмы, поскольку бензодиазепины и снотворные препараты угнетают дыхание. В педиатрической практике, по возможности, следует отдавать предпочтение неинвазивным процедурам, чтобы не причинять боль и не вызывать у ребенка тревогу. После ликвидации острых явлений пациент может быть выписан из стационара, если дозы принимаемых внутрь и ингаляционных препаратов обеспечивают стабильное состояние, а показатели ПСВ превышают 70–80% от прогнозируемых или наилучших для данного больного значений.
При выписке ребенку и членам его семьи должны быть даны четкие рекомендации:
- избегать контакта с причинным фактором, который способствовал возникновению данного обострения;
- продолжить медикаментозное лечение после выписки;
- обратиться к лечащему врачу в течение 24 часов после выписки.
При этом следует подчеркнуть необходимость постоянного, регулярного лечения в амбулаторных условиях, разработки плана амбулаторного наблюдения для достижения устойчивой ремиссии, наилучших возможных показателей легочной функции.
Возникновение тяжелого обострения указывает на необходимость пересмотра текущего и перспективного планов медикаментозного лечения.
7.5. Тактика ведения детей с сопутствующими заболеваниями
Бронхиальная астма и атопический дерматит. Современная терапия АД направлена на купирование острых проявлений болезни, устранение сопутствующих этому заболеванию кожных и внекожных проявлений и на профилактику рецидивов. Наружная терапия атопического дерматита подразумевает сочетанное использование топических противовоспалительных препаратов (стероидных и нестероидных), направленных на подавление аллергического воспаления в коже, а также смягчающих/ увлажняющих средств, влияющих на различные биохимические, физико-химические и морфологические процессы в коже (см. Национальную программу «Атопический дерматит у детей. Лечение и профилактика». М., 2000). В современных алгоритмах наружной терапии атопического дерматита средства специального ухода за кожей (увлажняющие и смягчающие) входят в число обязательных уже в период острых проявлений болезни, а при стихании кожного процесса применяются самостоятельно и регулярно в течение длительного времени. Для мытья ребенка используются высококачественные моющие средства с нейтральным рН=5,5, которые не нарушают водно-липидный баланс эпидермиса, а также его барьерные функции.
Бронхиальная астма и аллергический ринит. Руководства ARIA и GINA рекомендуют комбинированный подход к лечению астмы и аллергического ринита. Пациенты с аллергическим ринитом должны обследоваться на предмет астмы, так же как и пациентам с астмой необходимо исключать наличие аллергического ринита. Для лечения аллергического ринита используются различные группы препаратов, действие которых на симптомы аллергического ринита может отличаться (табл. 7.5.1.)
Таблица 7.5.1. Эффективность различных групп препаратов на симптомы аллергического ринита
Для терапии аллергического ринита и БА используют ступенчатый подход в зависимости от степени тяжести и его влияния на БА.
При интермиттирующем АР и персистирующем легком АР назначаются:
- H1-блокаторы внутрь или интраназально;
- H1-блокаторы внутрь + деконгестанты;
- ИГКС интраназально;
- кромоны, АТРЛ.
Эффективность терапии необходимо повторно оценить через 2–4 недели.
При персистирующем АР средней тяжести и тяжелом (поэтапный подход):
- интраназально ИГКС;
- если выраженная блокада: добавить короткий курс пероральных ГКС или деконгестантов;
- возможна комбинация с ЛТРА, Н1-блокаторами.
7.6. Реабилитация
Ключевые положения:
- целью реабилитации является профилактика инвалидизации и улучшение качества жизни детей, больных бронхиальной астмой;
- методы реабилитации включают базисную терапию, немедикаментозную терапию, психолого-педагогическую коррекцию, социальную поддержку;
- принципы реабилитации включают: раннее начало; непрерывность; создание индивидуальных программ (в зависимости от тяжести и наличия сопутствующей патологии); комплексный характер программ.
Основными направлениями реабилитационных мероприятий являются повсеместное создание оснащенных дневных стационаров в поликлиниках и реабилитационных центрах, совершенствование специализированной санаторной помощи на местах.
В современных условиях реабилитация приобретает новые ориентиры и направления:
- обеспечение доступности и качества реабилитационных мероприятий;
- формирование системы стандартизации и управление качеством;
- разработка автоматизированных методов оценки результатов реабилитации;
- разработка и внедрение ресурсосберегающих и высокотехнологичных протоколов реабилитации.
В решении проблемы бронхиальной астмы у детей существенная роль принадлежит вопросам ранней и долговременной реабилитации больных, поскольку от ее эффективности в детском возрасте зависит дальнейшее течение болезни и статус взрослого человека.
Бронхиальная астма у детей препятствует приобретению возрастных навыков, затрудняет воспитание и обучение, ведет к изоляции и социальной депривации (так как тяжелые больные не могут посещать детские дошкольные и школьные учреждения).
Комитет экспертов ВОЗ определяет реабилитацию как процесс, целью которого является предотвращение инвалидности в период лечения заболевания и помощь больному в достижении максимальной физической, психической, профессиональной, социальной и экономической полноценности, на которую он будет способен в рамках существующего заболевания. У больных детей (в отличие от взрослых) реабилитация:
- обеспечивает не только восстановление утраченных функций, но и дальнейшее возрастное развитие всех систем, предупреждая или существенно сглаживая задержку или дисгармоничность роста и развития;
- включает комплекс медицинских и педагогических мер, направленных на максимально полную адаптацию ребенка к окружающей обстановке, на устранение социальной недостаточности.
Эффективная реабилитация возможна только при соблюдении следующих условий:
- ранняя диагностика основного заболевания;
- своевременное выявление осложнений и сопутствующей патологии;
- адекватность этапа реабилитации тяжести и периоду заболевания;
- обучение медицинского персонала, воспитателей, педагогов, занятых работой с больными детьми на всех этапах оказания медицинской и психолого-педагогической помощи;
- привлечение и обучение родителей для обеспечения непрерывного мониторинга за состоянием ребенка и восстановительного процесса;
- составление индивидуальных и дифференцированных программ.
С целью осуществления дифференцированного подхода к восстановительным мероприятиям по отношению к каждому больному необходимо правильно определить его реабилитационный потенциал и прогноз.
Реабилитационный потенциал — комплекс биологических и психофизиологических характеристик человека, а также социально-средовых факторов, позволяющих в той или иной степени реализовать его потенциальные способности. Он определяется совокупностью медицинских, социальных, психологических и экономических факторов.
Реабилитационный прогноз исходит из предполагаемой вероятности реализации реабилитационного потенциала.
Медицинские аспекты, безусловно, занимают главное место в системе реабилитации. В этой связи при бронхиальной астме как в период обострения, так и в период ремиссии лечебные мероприятия необходимо направить на подавление основного морфологического субстрата — хронического воспаления дыхательных путей. При этом основная задача этапа реабилитации — максимальное использование немедикаментозных методов лечения.
В то же время эффективная реабилитация больных возможна лишь при комплексном воздействии на организм ребенка, в том числе и на сопутствующие заболевания, хронические очаги инфекции и т. д.
Реабилитация больных бронхиальной астмой немыслима без учета психологических факторов, оценки личности больного ребенка, отношения его и родителей к болезни и терапии. Зачастую здесь необходима консультация психолога и определяемые им различные методы индивидуальной или групповой психотерапии и психокоррекции. Важен и педагогический аспект реабилитации, затрагивающий коррекционновоспитательную работу с детьми.
Следует особо подчеркнуть, что родители — основные участники реабилитации, особенно если ребенок по тем или иным причинам не посещает учебно-воспитательное учреждение. Задача родителей — помочь ребенку в сложных условиях болезни, раскрыть весь заложенный в него природой потенциал развития, сформировать компенсаторные возможности, подготовить к школе, сделать максимально приспособленным к пребыванию в детском коллективе и в перспективе к максимальной интеграции в общество. Социальные аспекты реабилитации могут быть реализованы только после полноценного использования медицинской, психолого-педагогической работы: возвращения больного инвалидизирующей бронхиальной астмой в детское дошкольное учреждение, школу, коллектив сверстников. Поэтому эффективность реабилитационных мероприятий также должна рассматриваться в медицинском, психолого-педагогическом и социальном аспектах.
Санаторно-курортное лечение для больных бронхиальной астмой В современном комплексе лечебно-профилактических мероприятий важное место занимает санаторно-курортное лечение. Основными нормативными документами, регламентирующими деятельность детских пульмонологических санаториев, являются: «Санитарно-эпидемиологические требования к устройству, содержанию и организации работы детских санаториев», Санитарно-эпидемиологические правила и нормативы (СанПиН 2.4.2.2843–11); «О мерах по совершенствованию лечебного питания в лечебно-профилактических учреждениях Российской Федерации (приказы Минздравразвития России от 5 августа 2003 г. № 330, от 7 октября 2005 г., от 10 января 2006 г. № 2, от 26 апреля 2006 г. № 316); стандарты санаторно-курортной помощи (приказ Минздравразвития России от 22 ноября 2004 г. № 212). В санаторно-курортных условиях при БА рекомендуется:
- природные лечебные факторы (климатотерапия, спелеотерапия, галотерапия, бальнеотерапия, пелоидотерапия);
- лечебные факторы механической природы (лечебный массаж, баротерапия, рефлексотерапия, мануальная терапия и др.);
- аэрозольная (ингаляционная) терапия;
- лечебные физические факторы электромагнитной природы (лекарственный электрофорез, электросонтерапия, лечебное применение переменного электрического тока, электрического и магнитного полей и других методов аппаратной физиотерапии);
- лечебная физкультура.
Природные лечебные факторы
Климатотерапия — использование особенностей климата местности для лечения больных БА. Применяется воздействие климата лесов, гор, тропиков и субтропиков, морского климата.
Климат гор характеризуется пониженным атмосферным давлением и температурой воздуха, возрастающей спектральной плотностью ультрафиолетового излучения; возникающая в горах частичная тканевая гипоксия стимулирует приспособление систем жизнеобеспечения организма к условиям кислородной недостаточности, повышая степень функциональных резервов при бронхиальной астме.
Климат морей, островов, морских берегов характеризуется малой амплитудой колебаний суточной температуры воздуха, умеренной или высокой влажностью и высоким атмосферным давлением, высоким содержанием в воздухе кислорода аэроионов минеральных солей. При бронхиальной астме особенно показан теплый морской климат южных широт: высокая интенсивность солнечного излучения вместе с прибоем вызывают распыление и испарение капелек морской воды в воздухе. Содержащий микрокристаллы солей морской воздух вызывает гиперемию кожи и слизистых оболочек, восстанавливает их трофику, секреторную и выделительную функции, стимулирует репаративные процессы.
Климат тропиков и субтропиков отличается высокой и устойчивой температурой воздуха, минимальной скоростью ветра и высокой влажностью воздуха. Буйная растительность субтропиков выделяет в воздух большое количество ароматических летучих веществ и фитонцидов, которые вместе с аэроионами обладают бактерицидным и седативным действием. В «естественном ингалятории» тропиков и субтропиков у пациентов с БА восстанавливаются дренажная и секреторная функции легких, снижается повышенное кровяное давление.
Спелеотерапия, галотерапия — широко применяемые в течение столетий методики лечения больных с БА.
Спелеотерапия и галотерапия — это лечение пребыванием в условиях микроклимата естественных и искусственных пещер (соляных копей, шахт и др.). Основным действующим фактором воздушной среды соляных копей и пещер является мелкодисперсный аэрозоль солей натрия, кальция, калия и магния, а также отрицательные аэроионы.
Бальнеотерапия — это лечебное (наружное либо внутреннее) применение минеральных вод. Минеральные ванны оказывают лечебный эффект не только за счет температурного и механического факторов, но и за счет растворенных в воде химических ингредиентов. Контрастные ванны усиливают обмен веществ, нормализуют мышечный тонус, гемодинамику, повышают психоэмоциональную устойчивость, имеют эффект закаливания. У детей применяют преимущественно индифферентные (35–37), либо теплые ванны с температурой воды 38–39 градусов.
Лечебные души — это воздействие на организм струями воды различной формы, направления, температуры и давления. По виду воздействия души подразделяются на местные и общие, по возрастающей интенсивности механического воздействия общих душей (в форме струи) выделяют пылевой, дождевой, игольчатый, циркулярный, веерный, Шарко, шотландский, подводный душ-массаж (ПДМ). Лечебные души, ПДМ применяют в период ремиссии бронхиальной астмы, исключая тяжелое и крайне тяжелое течения заболевания.
Пелоидотерапия
Лечебные грязи — пелоиды (от греч. пелос — грязь) — природные органоминеральные коллоидальные образования, содержащие биологически активные вещества и живые микроорганизмы. Терапевтический эффект лечебных грязей обусловлен термическим, механическим, химическим и биологическим факторами. Нагретая лечебная грязь вызывает в месте аппликации повышение температуры кожи и подкожножирового слоя на 1,2–2,5 градуса Цельсия, в результате чего возникает местная гиперемия кожи, усиливается скорость кровотока и проницаемость сосудистой стенки, что способствует не только улучшению местного кровообращения и оксигенации тканей, но и ускорению транспортировки растворенных в грязи активных компонентов, которые, накапливаясь в коже, усиливают метаболизм (обмен веществ) подлежащих тканей, местный и общий иммунитет, трофику нервных окончаний.
Лечебные факторы механической природы
Лечебный массаж. Лечебные эффекты массажа при БА: тонизирующий, сосудорасширяющий, трофический, катаболический, лимфодренирующий, седативный, бронходренирующий.
Рефлексотерапия
Рефлексотерапия — это воздействия на биологически активные точки при помощи металлических игл, пальпации, магнитотерапии либо лазера. Лечебные эффекты при БА: спазмолитический, бронхолитический, сосудорасширяющий.
Аэрозольная терапия
Аэрозольные препараты при лечении БА не только заменяют перорально назначаемые лекарственные средства аналогичных групп, но и имеют много преимуществ: неинвазивность и возможность быстрого достижения лечебного эффекта по сравнению с пероральной терапией.
Аппаратная физиотерапия
Воздействие синусоидальными модулированными токами (амплипульстерапия) — переменными электрическими токами частотой 5000 Гц, модулированными по амплитуде. При БА вследствие воздействия синусоидальных модулированных токов на глубоколежащие ткани межэлектродного пространства, происходит воздействие не только на скелетные мышцы, но и на гладкие мышцы внутренних органов.
Воздействие диадинамическими токами (диадинамотерапия) — лечебное воздействие на организм диадинамическими импульсными токами.
Лечебные эффекты: мионейромиостимулирующий, анальгетический, сосудорасширяющий, бронхолитический, гипосенсибилизирующий. Воздействие высокочастотными электромагнитными полями (индуктотермия) — лечебное применение магнитной составляющей электромагнитного поля высокой и ультравысокой частоты. Лечебные эффекты при БА: противовоспалительный, сосудорасширяющий, секреторный, миорелаксирующий, иммунокорригирующий, катаболический.
Воздействие электромагнитным излучением дециметрового диапазона — дециметроволновая терапия (ДМВ) — лечебное применение электромагнитных волн дециметрового диапазона.
Воздействие электрическим полем ультравысокой частоты (УВЧтерапия) — УВЧ взаимодействует с тканями на всем протяжении межэлектродного пространства и вызывает колебательные и вращательные смещения биомолекул и образование токов проводимости значительной плотности. В механизме действия УВЧ-терапии условно выделяют нетепловой (осцилляторный) и тепловой компоненты.
Электрофорез лекарственных средств — сочетанное воздействие на организм постоянного электрического тока и вводимого с его помощью лекарственного вещества. При этом к механизмам действия постоянного тока добавляются лечебные эффекты вводимого лекарственного вещества. Лекарственные вещества в растворе диссоциируют преимущественно на ионы и заряженные гидрофильные комплексы.
Электросонтерапия — лечебное воздействие импульсных токов на гипногенные структуры головного мозга. Лечебные эффекты при БА: снотворный, седативный, спазмолитический, секреторегуляторный. Воздействие коротким ультрафиолетовым излучением. Лечебные эффекты при БА: бактерицидный и микоцидный (при облучении кожи и слизистых); иммуностимулирующий, катаболический.
Воздействие низкоинтенсивным лазерным излучением (лазеротерапия) — лечебное применение оптического излучения, источником которого является лазер. Для лечебного воздействия при БА используют преимущественно низкоинтенсивное лазерное излучение с плотностью потока энергии до 0,2 Вт • см-2 (нижняя граница теплового эффекта составляет 0,5 Вт • см-2 ).
Лечебная физкультура
При бронхиальной астме (БА) одним из эффективных дополнений к медикаментозной терапии является лечебная физкультура. Нормализация дыхания с техникой контроля глубины и темпа дыхания, а также техникой релаксации и постурального дренажа (улучшения отхождения мокроты) может значительно улучшить самочувствие пациента с БА и снизить лекарственную нагрузку. Осторожная и корректная программа упражнений лечебной гимнастики с дыхательными упражнениями, проводимая на фоне правильной медикаментозной терапии, позволяет значительно улучшить как краткосрочные, так и отдаленные исходы заболевания. Наиболее легко выполнимым и доступным упражнением для пациента, страдающего БА, являются пешие прогулки на короткие дистанции по ровной местности. Прогулка на улице в очень холодный или ветреный день — должны быть ограничены. «Сырая» и влажная погода тяжело переносится астматиками, поэтому лучше выполнять рекомендуемые упражнения в сухом и хорошо кондиционируемом помещении. Одна из лучших форм физической активности для пациента с БА — это плавание.
7.7. Диспансерное наблюдение детей, больных бронхиальной астмой
Ключевые положения:
- цель диспансерного наблюдения — предотвращение прогрессирования заболевания и достижение контроля БА;
- диспансерное наблюдение предусматривает этапность, доступность, преемственность на основе унифицированных подходов к диагностике, лечению и профилактике;
- одно из главных условий диспансерного наблюдения детей с БА — мониторирование заболевания участковым педиатром и специалистами.
Организация диспансерного наблюдения
В 80-х гг. ХХ столетия МЗ были изданы приказы по диспансеризации при различных заболеваниях, в том числе бронхиальной астме, определявшие основные правила ведения пациентов: частота и характер осмотра специалистами, оздоровительные мероприятия, длительность наблюдения и критерии снятия с учета. В настоящее время актуальность диспансеризации существенно возросла в связи с прогрессирующим ростом распространенности бронхиальной астмы и других аллергических заболеваний. В 2010 г. изданы приказы о порядке оказания медицинской помощи: приказ Минздравсоцразвития России от 4 февраля 2010 г. № 60н «Об утверждении порядка оказания медицинской помощи больным с аллергическими заболеваниями и болезнями, ассоциированными с иммунодефицитами», и приказ Минздравсоцразвития России от 7 апреля 2010 г. № 222н «Порядок организации оказания медицинской помощи больным с бронхо-легочными заболеваниями пульмонологического профиля» (см. приложение), в которых диспансеризация не нашла должного отражения. Согласованное мнение экспертов по диспансеризации детей с БА приводится в данном разделе.
Диспансерное наблюдение является одним из важных компонентов успешного лечения больного БА, которое проводят участковый педиатр (врач общей практики или семейный врач) и врач специалист аллерголог и/или пульмонолог. В диспансеризации при необходимости участвуют и другие врачи-специалисты: отоларинголог, дерматолог, окулист, гастроэнтеролог, кардиолог, стоматолог, фтизиатр, медицинский психолог.
В диспансерном наблюдении нуждаются не только больные БА, но и дети, имеющие высокий риск формирования заболевания. В группу повышенного риска включаются дети с отягощенным аллергологическим анамнезом и имеющие проявления атопии (аллергический ринит, атопический дерматит, крапивница, ангионевротический отек).
При диспансерном наблюдении осуществляется ежегодная оценка и переоценка тяжести БА и, при необходимости, коррекция терапии.
В задачи участкового педиатра входят:
- раннее выявление детей с БА;
- наблюдение детей с риском развития БА проводится в декретированные сроки: на первом году — ежемесячно первые 6 мес., затем в 9 и 12 мес., далее ежегодно;
- нередко начальные проявления БА протекают под маской респираторной инфекции, в связи с чем так называемые «часто болеющие дети» требуют углубленного обследования и направления к специалистам;
- контроль за детьми с БА осуществляется в соответствии с индивидуальным планом наблюдения: пациентов с легкой БА 1 раз в 12 мес., среднетяжелой и тяжелой БА — не реже 1 раза в 6 мес. (с исследованием ФВД);
- амбулаторное лечение БА проводится по показаниям или по рекомендации специалиста;
- оценка эффективности начальной противовоспалительной базисной терапии у детей со среднетяжелой и тяжелой БА проводится через 1 мес., далее при эффективности терапии — через 3–6 мес. При неэффективности необходима госпитализация в специализированный стационар;
- обязательный компонент — выявление и санация очагов хронической инфекции;
- отбор детей с БА для этапного лечения в местных санаториях, специализированных детских санаториях, в специализированных детских дошкольных учреждениях и оздоровительных лагерях;
- организация восстановительного комплексного лечения;
- оформление медицинских заключений для детей-инвалидов с тяжелой БА;
- советы по профориентации больного ребенка.
План диспансеризации детей с БА согласовывается с аллергологом и/или пульмонологом. При наличии сопутствующего аллергического ринита, атопического дерматита — с отоларингологом, дерматологом. При необходимости привлекаются другие специалисты: гастроэнтеролог, кардиолог, фтизиатр, окулист, стоматолог. Диспансерный осмотр специалистом проводится, при легкой и средней тяжести БА — 2 раза в год; при тяжелой — 4 раза в год.
В амбулаторных условиях основой профилактики обострений БА является разобщение больного с «виновными» и потенциальными триггерами. Перечень непереносимых аллергенов обязательно отражается на титульном листе истории развития больного ребенка. Учитывая особенность детей с атопией быстро расширять спектр сенсибилизации при контакте с высокоаллергенными воздействиями среды, необходимо ограничивать в диете и быту больных не только те аллергены, к которым выявлена сенсибилизация, но проводить весь комплекс мероприятий (гл. 1). Реализация этого возможна только при постоянном тесном контакте участкового педиатра с родителями.
Способствовать нарастанию уровня сенсибилизации и усугублять течение БА могут очаги хронической инфекции. Для своевременного выявления и санации очагов инфекции детей с БА в период ремиссии не реже 1 раза в 6 месяцев осматривают стоматолог и отоларинголог.
Этапы диспансерного наблюдения регистрируются в истории развития ребенка (форма 112), календарный план диспансеризации — в карте диспансерного наблюдения (форма 30). В конце календарного года участковый педиатр оформляет в истории развития ребенка эпикриз, в котором отражает динамику течения БА (тяжесть, частоту обострений), проведенное лечение, его эффективность (контролируемость). С учетом этих данных составляется план диспансерного наблюдения на следующий год.
При диспансеризации у специалистов (аллерголог/ пульмонолог) уточняется или подтверждается диагноз БА (см. табл. 7.7); выясняется, выполняет ли в полном объеме пациент назначения врача и соблюдает ли он рекомендации по режиму. Необходимо просмотреть дневник пациента, график пикфлоуметрии за прошедший период и прокомментировать правильность их ведения и полученную информацию. Важно, чтобы пациент на визит приносил свой пикфлоуметр и ингаляционные формы лекарств для проверки техники выполнения ингаляций и маневра пикфлоуметрии. Оцениваются побочные эффекты и безопасность принимаемых препаратов. Проводится исследование ФВД с бронхолитическим тестом.
Отношения семьи и врача должны быть доверительными. Важно понять, осознает ли пациент (семья) смысл проводимого лечения, ориентируется ли в группах препаратов. Ответить на вопросы пациента. Пригласить его на занятия в астма-школу. В заключение приема врач дает подробные письменные рекомендации по режиму и терапии. Проверяет, понял ли пациент (семья), как правильно выполнять эти назначения. Определяет дату следующего посещения. Вся эта информация отражается в амбулаторной карте пациента.
Таблица 7.7. Диспансерные группы у специалиста
| Характеристика группы | Частота осмотра |
|---|---|
| БА | Легкая—1 раз в 6 мес. средней тяжести, тяжелая—1 раза в 3–6мес. В период проведения АСИТ |
| БА и АР | Не реже 1 раза в 6 мес. В период проведения АСИТ |
| БА и атопический дерматит | 1 раз в 3–6 мес. В период подбора диеты—1 раз в 7–14 дней |
Больные с БА получают рекомендации по элиминационным мероприятиям, базисной терапии; обучаются методам мониторирования течения заболевания (дневник пациента, пикфлоуметрия) и направляются для диспансерного наблюдения к участковому педиатру. Участковый педиатр направляет больных с БА для аллергообследования (1 раз в год). Дети с установленным диагнозом находятся на диспансерном наблюдении, им проводится необходимое лечение, в том числе в условиях отделения восстановительной медицины или дневного стационара. Перевод детей с БА на обследование и лечение в специализированное отделение осуществляется с учетом течения болезни.
Диспансерное наблюдение пульмолонолом /аллергологом:
- углубленное обследование ФВД, анализ показателей пикфлоуметрии;
- проведение аллергологического обследования;
- при выявленных причинно-значимых аллергенов проведение АСИТ (только аллерголог);
- назначение базисной терапии первичным больным БА с учетом тяжести болезни;
- при повторных визитах оценка эффективности терапии БА по клиническим данным, показателям ФВД) и пересмотр терапии по необходимости;
- наблюдение и проведение лечения сопутствующих АР, АД;
- рекомендации по элиминационным мероприятиям;
- направление на восстановительное лечение и санаторно-курортное лечение;
- рекомендация по оформлению инвалидности;
- рекомендации по занятиям спортом, дыхательной гимнастикой, профориентации;
- организовывать и проводить образовательные программы с учетом возраста.
Многообразие клинических вариантов, отличающихся по тяжести, ответу на проводимую терапию, сочетанию заболеваний, по социальному статусу и психологическому настрою семьи требует от врача дифференцированного индивидуального подхода в каждом случае.
Показания к госпитализации:
- проведение дифференциальной диагностики астмы в сомнительных случаях при невозможности ее проведения в условиях поликлиники (соматическое, пульмонологическое и аллергологическое отделения);
- обострение (приступ) астмы, не купирующийся в амбулаторных условиях (соматическое, реанимационное отделение);
- астматический статус (реанимационное отделение);
- подбор схем терапии у больных с тяжелой, резистентной к обычной терапии астмой (аллергологическое, пульмонологическое отделения);
- возможные выраженные побочные эффекты противоастматических препаратов.
Важным этапом диспансерного наблюдения и комплексной терапии детей с астмой является санаторно-курортное лечение. Больных направляют в санаторий в период ремиссии, после проведения аллергообследования и санации очагов инфекции.
Критерии эффективности диспансеризации:
- частота обострений астмы и их суммарная продолжительность;
- длительность и полнота ремиссии (полный контроль астмы);
- дни нетрудоспособности матери в связи с уходом за ребенком, дни пропущенных занятий в школе;
- количество дней, проведенных больным в стационаре за год;
- динамика показателей ФВД в период ремиссии.
Следует помнить, что длительная ремиссия БА не гарантирует от рецидива заболевания. При длительном отсутствии обострений БА целесообразно констатировать не выздоровление, а стойкую ремиссию и продолжить наблюдение детей этой группы в условиях педиатрического участка. На данном этапе диспансерного наблюдения в задачи участкового педиатра входит контроль стабильности ремиссии, ежегодное исследование ФВД.
После достижения 18 лет пациенты с БА передаются под наблюдение терапевта (врача подросткового кабинета) и в случае необходимости, пульмонолога/аллерголога. Для обеспечения преемственности диспансерного наблюдения участковый педиатр оформляют передаточный эпикриз. В эпикризе отражают анамнез жизни, этапы развития болезни, частоту госпитализаций, данные аллергообследования, количество курсов АСИТ. Указывают препараты, применяемые для купирования приступов, препараты, контролирующие астму, длительность и частоту их применения. Указывают динамику тяжести течения болезни и ее контролируемость в разные возрастные периоды и на момент передачи пациента. Приводят данные ФВД.
Профессиональная ориентация
Врач, у которого подросток состоит на диспансерном учете, проводит врачебно-профессиональное консультирование. При астме не рекомендуются профессии, связанные с физическим перенапряжением, с воздействием неблагоприятных метеорологических факторов, ингаляционных и контактных аллергенов (шерсть, мех, медикаменты, химикаты, пыль). Способствовать прогрессированию заболевания может профессиональный контакт с веществами, оказывающими токсическое или механическое воздействие на органы дыхания (ингаляционные ирританты, цемент, лаки, краски, органические растворители и др.).
Среднее и высшее специальное образование рекомендуется по следующим специальностям: электромашиностроение, контрольно-измерительные приборы, связь, радиовещание и телевидение, экономика, математика, история, искусствоведение, здравоохранение, юриспруденция, гуманитарные и лингвистические направления.
Вакцинация детей, больных бронхиальной астмой
С современных позиций вакцинация детей с бронхиальной астмой занимает ведущее место в превентивной педиатрии. Обоснована необходимость обеспечения детей с заболеваниями респираторной системы своевременной безопасной вакцинацией в соответствии с календарем прививок, а также дополнительного введения в их индивидуальный график иммунопрофилактики прививок против пневмококковой и гемофильной тип В инфекций.
Целесообразно вакцинировать детей с бронхиальной астмой, ведущими триггерами обострения у которых являются респираторные инфекции. При этом необходимо соблюдать следующие моменты:
- иммунизация проводится у детей с бронхиальной астмой только в периоды ремиссии (в том числе и медикаментозной) длительностью не менее 4–8 нед.;
- при рецидивировании респираторной патологии верхних и/или нижних дыхательных путей, способствующей неконтролируемому течению бронхиальной астмы, может быть индивидуально решен вопрос о целесообразности вакцинации пневмококковой инфекции (ПКИ7 или Пневмо-23), у детей раннего возраста групп риска — против гемофильной инфекции (АктХиб; Пентаксим или Хиберикс);
- иммунизации не подлежат дети во время обострения бронхиальной астмы независимо от степени тяжести;
- вакцинация всегда проводится на фоне базисной терапии основного заболевания;
- проблемным детям вакцинацию осуществляют в специализированном стационаре или в центрах (кабинете) иммунопрофилактики;
- дети, получающие специфическую аллерговакцинацию (АСИТ), могут быть вакцинированы только по строгим эпидемиологическим показаниям бесклеточной коклюшной вакциной или АДС, АДС-М, противополиомиелитной инактивированной вакциной через 2–4 нед. после введения очередной дозы аллергена с последующим продолжением АСИТ через 4–5 нед. после вакцинации.
При этом АСИТ необходимо продолжить с введения того разведения, которое использовалось перед вакцинацией. Кожные пробы с аллергенами могут быть поставлены за 10–15 дней до или через 1,5–2 мес. после введения вакцинных препаратов. При сочетании бронхиальной астмы с поллинозом вакцинацию детей нельзя проводить в период цветения растений — с апреля по октябрь.
Учитывая то, что острые респираторные инфекции являются наиважнейшими триггерами бронхиальной астмы, все мероприятия, направленные на профилактику ОРЗ у детей с бронхиальной астмой, часто болеющих ОРЗ, представляются перспективными. В комплекс мероприятий входят как общеукрепляющие мероприятия, закаливание и т. д., так и использование специальных топических поливакцинных препаратов, а также средств профилактики вирусных инфекций — индукторов эндогенных интерферонов. Использование комплекса этих мероприятий позволяет снизить частоту интеркуррентных острых респираторных заболеваний и обострений очагов хронической инфекции и тем самым способствует урежению обострений бронхиальной астмы.
Вместе с тем следует учитывать, что данных для оценки всех преимуществ и риска вакцинации у детей с бронхиальной астмой недостаточно, что требует разумной осторожности и проведения дальнейших исследований.
7.8. Немедикаментозные методы лечения
Ключевые положения:
- немедикаментозные методы направлены в основном на устранение причинно-значимых внешних факторов и тренировку систем, обеспечивающих компенсацию биологических дефектов, что позволяет эффективно использовать их на ранних стадиях заболевания;
- немедикаментозные методы хорошо сочетаются с базисной терапией;
- немедикаментозные методы позволяют уменьшить объем и длительность применения лекарственных препаратов;
- при правильно выбранных показаниях немедикаментозные методы не приводят к каким-либо осложнениям;
- лечение немедикаментозными методами надо проводить в условиях мониторинга состояния больного и под контролем специально обученного врача или опытного методиста так как после применения некоторых методик у ребенка при субъективном улучшении не наблюдается улучшения функции легких;
- контроль эффективности осуществляется по тем же параметрам, как при медикаментозной терапии; • при сборе анамнеза следует обращать внимание на использование немедикаментозных методов лечения; • немедикаментозные методы используются недостаточно.
Диетотерапия
Положительное влияние на течение бронхиальной астмы оказывает индивидуально подобранная диета с исключением из рациона аллергенных продуктов, специфичных для данного больного.
Дыхательная гимнастика
Физическая реабилитация детей с бронхиальной астмой обязательно включает различные аспекты дыхательной гимнастики. Лечение «дыхания через дыхание» особенно важно в детском возрасте.
Цель тренировки дыхания с помощью различных методик преследует, в частности, повышение устойчивости к гипоксическим и гиперкапническим воздействиям.
Сознательный контроль дыхания — один из самых древних методов борьбы со стрессом и функциональными нарушениями дыхания. Обучение управлению дыханием включает гиповентиляционные упражнения (волевое управление дыханием — метод Бутейко, упражнения йогов), дыхание через сопротивление, медленный удлиненный вдох, пассивный выдох, звуковую гимнастику, абдоминальное дыхание. Многие современные методики имеют в своей основе приемы, уходящие в древнюю народную восточную медицину. Субъективно у больных может улучшаться состояние и самочувствие, но отсутствует улучшение со стороны функции внешнего дыхания.
Необходимо помнить, что правильное дыхание — когда в нем принимает участие вся дыхательная система (грудная клетка и диафрагма). Всякое грубое вмешательство в дыхание как саморегулирующую функцию, стремление внести оригинальность в методику — недопустимо. Основная задача дыхательной гимнастики, кроме чисто лечебных целей — обучение и тренировка правильного, гармонического нормального дыхания.
Эффективны и полезны у детей звуковая дыхательная гимнастика, пение, дыхательные тренажеры с использованием игровых эффектов.
Дыхательная гимнастика тесно связана с релаксационной и аутогенной тренировкой. Ребенок учится дышать максимально расслабленно в различных позах и при физических нагрузках, эти навыки переносятся в повседневную жизнь, что позволяет уменьшить реакцию дыхания на различные стрессовые воздействия.
В современной педиатрии широкое распространение получили методы интервальной гипоксической тренировки (ИГТ) у детей с бронхиальной астмой с использованием аппаратов гипоксикаторов, позволяющих создавать во вдыхаемой газовой смеси пониженную концентрацию кислорода (до 11–12%). Курсы дозированной гипоксии позволяют осуществлять комплексную тренировку различных функциональных систем организма ребенка за счет «перекрестной адаптации», которая происходит без стресса и, соответственно, без больших энергетических затрат. При гипоксической гипоксии мобилизуется специфическая функциональная система организма ребенка, ответственная за транспорт и утилизацию кислорода.
Лечебная физкультура
Согласно современным данным лечебная физкультура (ЛФК) может служить методом и патогенетической, и неспецифической терапии.
В современной литературе механизм действия ЛФК рассматривается как результат стимулирующего, трофического и компенсаторного эффекта физических упражнений с учетом адаптации к физической нагрузке.
Лечебная физкультура — это универсальный метод мобилизации саногенетических резервов организма, повышения адаптационных систем к стрессовым, экологическим и техногенным влияниям.
В педиатрической практике у больных с бронхиальной астмой дозированные физические нагрузки обязательно сочетаются с дыхательной гимнастикой. Хороший эффект у детей дают общеразвивающие упражнения, упражнения на расслабление и координацию. В результате специальных дыхательных упражнений дыхательная мускулатура, и прежде всего мышцы, участвующие в выдохе, обретает достаточную силу и выносливость, нормализуется кровообращение.
Лечебная физкультура для больных бронхиальной астмой должна стать частью повседневной жизни.
Массаж и вибромассаж
Массаж направлен на уменьшение выраженности бронхоспазма, гиперреактивности бронхов, увеличение количества отделяемой мокроты, повышение силы и выносливости дыхательной мускулатуры. Простота выполнения вибрационного массажа и хорошая переносимость его детьми, возможность использования в комплексе с другими методами терапии позволяют рекомендовать этот вид лечения для широкого практического использования на всех этапах медицинской реабилитации детей с бронхиальной астмой. Ручной массаж проводится детям в следующих модификациях: классический, дифференцированный, сегментарный, точечный.
Классический массаж показан всем больным, не имеющим общих противопоказаний для его проведения. Курс лечения с помощью общепринятой методики классического массажа составляет 10–12 процедур. Для использования массажа в качестве поддерживающей профилактической терапии в домашних условиях целесообразно обучать родителей приемам массажа грудной клетки.
Подводный душ-массаж при любой методике его применения оказывает общее действие на организм. Повышая силу основных корковых процессов в центральной нервной системе, процедура оказывает влияние на психосоматическое состояние ребенка. После подводного массажа улучшаеться самочувствие, появляется легкость, бодрость. Курсовое лечение (10–15 сеансов) вызывает тонизирующий эффект на длительный период времени, повышает работоспособность, нормализует сон.
Спелеотерапия и горноклиматическое лечение
Накоплен значительный положительный опыт использования спелеотерапии и галотерапии, на фоне которых у пациентов уменьшается частота и тяжесть приступов удушья, снижается количество употребляемых препаратов, улучшаются показатели ФВД, вегетативная регуляция.
Указанные положительные сдвиги сохраняются в течение 3–6 мес. В основе терапевтического воздействия горного климата при бронхиальной астме у детей лежат универсальные адаптационные реакции.
Конкретными звеньями механизма терапевтического воздействия горного климата являются особенности биомеханики дыхательного процесса в условиях разреженной атмосферы, экстренная адаптационная реакция организма на горную гипоксию, заключающаяся в активации функций систем дыхания, кровообращения, эритрона, переходящая в дальнейшем на более экономные адаптационные режимы; стрессреакция на горный климат с изменением функций вегетативной нервной системы, повышенным выделением в русло крови гидрокортизона и альдостерона; повышение чувствительности адренорецепторов и снижение чувствительности холинорецепторов, увеличение чувствительности больного ребенка к адреналину и гидрокортизону; иммунная перестройка организма.
Даже после однократного горноклиматического лечения, у больных легкой и среднетяжелой бронхиальной астмой удлиняется продолжительность межприступного периода, снижается тяжесть приступов удушья, уменьшается частота острых респираторных заболеваний. У большинства детей благоприятное действие горного климата сохраняется в течение 2–3 лет. Сходные эффекты достигаются в амбулаторных условиях при использовании гипоксической баротерапии.
Физиотерапия
В последние годы физиотерапия бронхиальной астмы пополнилась новыми методами. Магнитотерапия (магнитофоры, магнитные поля) оказывает иммунокорригирующий эффект, улучшает функцию внешнего дыхания и бронхиальную проходимость, уменьшает проявления воспаления в слизистой оболочке респираторного тракта.
К весьма перспективным методам лечения бронхиальной астмы относят лазерную терапию. Показано, что низкоинтенсивное лазерное излучение ближнего инфракрасного диапазона обладает бронхорасширяющим и десенсибилизирующим действием, улучшает легочный кровоток, корригирует процессы перекисного окисления липидов и иммунологические показатели, нормализует ферментный статус лимфоциов. Лазеропунктура стимулирует функцию коры надпочечников в части продукции глюкокортикоидов по данным содержания в крови уровня кортизола.
Бальнеотерапия
Водолечение является одним из важнейших звеньев физиотерапии, нашедшим широкое применение в лечебной практике, а также в профилактической медицине для закаливания и укрепления организма. Кожа является огромным рецепторным полем, в ней располагаются биологически активные точки, участки, поля и зоны, на которые можно воздействовать с помощью водных процедур. С помощью термических, механических и физико-химических свойств воды можно вызвать стимуляционный, тонизирующий либо седативный эффект. Механизм действия воды обусловлен сложными местными и общими нейрорефлекторными реакциями организма и основан на сочетании термического, механического, физико-химического, психотерапевтического факторов.
Одной из самых распространенных водолечебных и профилактических процедур являются ванны. Ванны могут быть общими, местными, для подводного душа-массажа. Душ-массаж проводят в специализированной углубленной и наполненной водой ванне, под давлением водяной струи от 1 до 2–3 атм. Подводный массаж отпускают и в приспособленном бассейне. Методику избирают согласно характеру заболевания, возрасту и индивидуальным особенностям ребенка, но при этом всегда соблюдают общие правила массажа.
В основе механизма действия лежит температурное и механическое раздражение, где прекрасно сочетаются воздействие теплой ванны и массажа. Данное воздействие вызывает расслабление мышц, гиперемию кожи за счет перераспределения кровотока. Улучшается лимфообращение и питание тканей.
Одним из сочетанных воздействий воды и движений, а также воздуха, солнца, аэрозолей, эмоционального восприятия являются купания.
Купания — весьма распространенная лечебно-профилактическая процедура. Различают купания в естественных водоемах: моря, реки, озера и в искусственных закрытых и открытых бассейнах. Отличительной особенностью механизма действия купания по сравнению с другими водолечебными процедурами является то, что купание всегда сопровождается мышечной работой и при этом изменяет реакцию механизмов терморегуляции и нервно-сосудистой системы. Улучшается отток крови и лимфы с периферии, способствуя их лучшей циркуляции, создаются благоприятные условия для работы сердца.
Фитотерапия. При бронхиальной астме применяются растения, которые относят к группе препаратов, обладающих противовоспалительными свойствами: алтей лекарственный, девясил высокий, зверобой продырявленный, календула лекарственная, подорожник большой и др.
Солодку голую (корневище и корни) издавна применяли в народной медицине почти во всех лечебных сборах. За последнее время интерес к солодке значительно повысился в связи с изучением обнаруженных в ней тритерпиновых соединений, близких по строению к глюкокортикостероидам. Корень и корневище солодки обладают выраженным отхаркивающим, разжижающим мокроту, спазмолитическим, противовоспалительным действием.
Противопоказанием к фитотерапии служит пыльцевая сенсибилизация. Необходимо учитывать места сбора лекарственных растений для предупреждения экологических загрязнений.
Психотерапия
Выявление психологических особенностей больных, своевременная диагностика и психотерапевтическая коррекция нервно-психического статуса больного являются необходимыми компонентами терапии бронхиальной астмы у детей. Работа психолога, начатая на ранних этапах заболевания, способствует преодолению раздражения и депрессии, связанных с хроническим течением болезни, и страха перед физической нагрузкой. Различные методы, основанные на биологической обратной связи, релаксационной терапии, индивидуальной, семейной и групповой психологии, целесообразно использовать в лечении бронхиальной астмы у детей.
7.9. Образовательные программы для пациентов с бронхиальной астмой и их родителей
Ключевые положения:
- образовательные программы являются неотъемлемой частью комплексного лечения детей с бронхиальной астмой; целью проведения программ является развитие сотрудничества между врачом и пациентом, врачом и родителями;
- особенностью таких программ в педиатрии является обязательная адаптация обучающих методов к восприятию группы пациентов с учетом их психомоторного развития и возрастных особенностей психологии.
Особую группу обучения составляют подростки с бронхиальной астмой;
- существуют различные формы и методы обучения пациентов: индивидуальные и групповые методики, видеообучение, специализированные интернет-сайты, адаптированные программы для детей младшего возраста (сказкотерапия), тренинги с участием психологов. Одной из распространенных форм является Астма-школа;
- обучение пациентов, их родителей и родственников должно проводиться на всех этапах оказания медицинской помощи пациентам с бронхиальной астмой;
- образовательные программы должны быть направлены не только на семью больного, но и на врачей, средний медперсонал, педагогов, постоянно занимающихся с ребенком, страдающим бронхиальной астмой;
- психологическая помощь, осуществляемая параллельно с занятиями в Астма-школе, существенно повышает эффективность образовательных программ и улучшает комплаенс.
Обучение пациентов и их родителей является неотъемлемой частью комплексной программы лечения бронхиальной астмы. Основной целью проведения образовательных программ является повышение мотивации лечения — активного и сознательного следования врачебным рекомендациям. Развитие сотрудничества между врачом и пациентом (комплаенс, кооперативность) — обязательное условие успешного обучения.
Бронхиальная астма требует от родителей и больного длительного, иногда непрерывного и тщательного соблюдения медикаментозных программ, особого режима жизни, целого ряда ограничений. От соблюдения этих условий зависит успешность предлагаемых специалистом программ ведения больных. Только мотивированный в процессе обучения пациент, осознающий необходимость элиминационных мероприятий, овладевший самоконтролем и ориентирующийся в лекарственной терапии будет следовать данным рекомендациям.
Никакие самые современные методы лечения не окажут должного эффекта, если пациент не будет четко следовать врачебным рекомендациям. Недостаточная осведомленность родителей об основных этиологических факторах, лежащих в основе развития и обострений бронхиальной астмы, а также о существующих современных методах лечения приводит к тому, что многие из пациентов игнорируют назначения врачей, самостоятельно прекращают лечение или прибегают к услугам парамедиков.
Приверженность лечению (комплаенс) характеризуется отношением количества реально принятого препарата к теоретически назначенному. Возможные нарушения вследствие недостаточного комплаенса: передозировка, уменьшение дозы и беспорядочный прием лекарств. Обучение пациентов должно начинаться с момента постановки диагноза и продолжаться на протяжении всего периода наблюдения.
При выборе метода и формы обучающих программ должен учитываться возраст пациентов. При лечении детей младшего возраста главным объектом обучения являются родители или лица, ухаживающие за ребенком. Используя адаптированные программы для детей младшего возраста, можно научить простым навыкам контроля детей начиная с трехлетнего возраста. Подростки — это особая группа со специфической возрастной психологией, нуждающаяся в использовании специальных программ, наиболее эффективными из которых являются тренинги с участием психолога. Внедренный в клиническую практику на протяжении последних лет обучающий тренинг для подростков с астмой «ПАРУС» (Подростки с бронхиальной астмой — российская универсальная система обучения) продемонстрировал свою высокую эффективность в этой возрастной группе, что объясняется учетом возрасной психологии и специальной подготовкой врачей для проведения этой методики.
Существуют различные формы и методы обучения. Наиболее широко применимы такие формы обучения, как непосредственные занятия с больными (групповой или индивидуальный метод), различные виды печатных изданий для пациентов (книги, газеты, брошюры, буклеты, журнал «Астма и аллергия» и т. п.), аудиои видеокассеты, специальные компьютерные программы, обучающие интернет-сайты, консультативные телефонные линии «Астма-помощи».
Индивидуальный метод обучения — один из самых продуктивных, но одновременно и наиболее трудоемких. Индивидуальное обучение проводится лечащим врачом, который детально знает особенности течения заболевания у данного пациента, контролирует и совершенствует знания и навыки больного на каждом визите.
Ключевыми моментами индивидуального обучения являются развитие партнерства, длительный обмен информацией, обсуждение полученных результатов. Ведущая роль в данной программе отводится первой консультации, во время которой рекомендуется дать информацию о диагнозе и простые сведения о существующих видах лечения, продемонстрировать различные виды ингаляторов, чтобы больной мог принять участие в выборе приспособления, которое наиболее ему подходит. Следует дать возможность пациенту высказать свои опасения по поводу бронхиальной астмы и ее лечения и обсудить их. На основании этого врач и больной должны прийти к согласию по поводу целей лечения. Уже при первом визите проводится обучение пациентов правильной технике пикфлоуметрии и ведению дневников. В завершение первой консультации рекомендуется предоставить больному письменную информацию о бронхиальной астме и ее лечении для закрепления полученной вербальной информации.
При последующих консультациях рекомендовано разработать совместно с пациентом (или родителями) план самоведения. Текущие консультации при индивидуальном обучении больного должны включать проверку техники ингаляционной терапии, проверку записей симптомов и показателей пикфлоуметрии в дневнике больного, а также проверку следования медикаментозному плану и выполнения рекомендаций по вторичной профилактике.
Наиболее распространенным методом обучения в России стал групповой метод, позволяющий одновременно вовлекать в процесс многих пациентов. Наиболее часто этот метод реализуется в Астма-школах.
Группы Астма-школ могут быть сформированы как из родителей, так и из самих пациентов старше 7 лет. Основные принципы формирования групп больных для Астма-школ предполагают обязательное подтверждение диагноза, учет возраста пациентов (разброс не более 3 лет), оптимально — одинаковую степень тяжести заболевания. Важно учитывать, что родители с депрессивными тенденциями и высоким уровнем тревожности, изначально ориентированные на немедикаментозные методы лечения, мало подходят для групповых занятий и должны обучаться индивидуально.
В организации работы Астма-школ очень важна подготовка специалистов для проведения занятий, желателен предыдущий педагогический опыт и знание основ психологии, в том числе детского и подросткового возраста. Тематические курсы усовершенствования, дающие врачам коммуникативные навыки работы с пациентами, проводимые с участием психологов,— оптимальный вариант подготовки специалистов для Астма-школ, что демонстрирует опыт подготовки врачей для методики «ПАРУС» (подробности на сайте http://lech.mma.ru/child).
Методически необходимо предусмотреть минимальное оборудование для занятий — печатные издания, плакаты, возможность видеообучения, наличие демонстрационных образцов различных средств доставки, пикфлоуметров и т. п.
Обязательным условием является, чтобы подходы к лечению у врача, проводящего занятия в Астма-школе, и врачей, направляющих пациентов на обучение, были едиными.
Несмотря на разнообразие вариантов проведения Астма-школ по длительности и интенсивности обучения, программа для пациентов и родителей обязательно должна включать следующие темы:
- элементарные сведения об анатомии, физиологии дыхания, сущности заболевания;
- понимание бронхиальной астмы как хронического заболевания, а потому необходимости постоянного контроля и лечения;
- сведения об основных аллергенах и ирритантах, принципах элиминационной терапии и аллерген-специфической иммунотерапии;
- самоконтроль состояния: симптомы и оценка пикфлоуметрии, навык измерения ЧСС, ЧД, заполнения дневника самонаблюдения;
- базовые знания об основных группах препаратов для лечения бронхиальной астмы, понятие базисной и симптоматической терапии;
- знакомство с основными видами средств ингаляционной доставки препаратов и освоение техники ингаляции;
- разбор алгоритмов действий при приступе и обострении бронхиальной астмы, планы самоконтроля в «системе цветовых зон»;
- характеристика основных немедикаментозных методов лечения (различные методики дыхательных гимнастик, массажа, закаливания, физиолечения) как альтернативных и вспомогательных вариантов терапии;
- обучение родителей необходимым навыкам экстренной доврачебной помощи (устранение неблагоприятных факторов, водный режим, элементы релаксации, дыхательная гимнастика, психотерапевтические приемы; медикаментозное лечение, организационные вопросы);
- обсуждение вопросов социальной и психологической адаптации детей с бронхиальной астмой и профориентации.
Таблица 7.9. Уровень кооперативности пациента в зависимости от возраста*
| Возраст | Описание кооперативности пациента |
|---|---|
| Дети до 5 лет |
Способны пассивно выполнять просьбы взрослых (прием таблеток, ингаляция через спейсер с помощью родителя и т. п.) |
| 5–7 лет |
Способны освоить большинство необходимых навыков (пикфлоуметрия, применение различных видов ингаляторов и т. п.), но под контролем и при напоминании взрослых членов семьи |
| 8–10 лет |
Способны к пониманию целесообразности назначения лекарственных средств, ориентируются в их названиях, целях их применения, побочных эффектах, противопоказаниях |
| 11–12 лет |
Правильно оценивают свое состояние до и после приема лекарственных средств и активно участвуют в подборе медикаментозной терапии под контролем взрослого, самостоятельно и регулярно используют пикфлоуметр и ведут дневник самонаблюдения |
| 13–14 лет |
Способны не только демонстрировать хорошее знание препаратов, но и планировать свое лечение без участия взрослых членов семьи, без напоминания самостоятельно контролируют наличие необходимого препарата на неделю вперед, самостоятельно ведут и хранят дневники самоконтроля без участия взрослых членов семьи |
* По данным Howell J.H. et al
Весь этот объем необходимых знаний и навыков может быть реализован в процессе проведения различного количества занятий: от 2–3 до 8–10. В России есть опыт проведения Астма-школ на базах специализированных санаториев, стационаров, поликлиник. При этом надо понимать, что Астма-школа лишь базовый этап обучения. Совершенствование и контроль знаний и навыков должны длиться на протяжении всего наблюдения пациента.
Особенностью образовательных программ в педиатрии является обязательная адаптация обучающих методов к восприятию возрастной группы пациентов с учетом их психомоторного развития и возрастных особенностей психологии (табл. 7.9).
Легко воспроизводимы и эффективны методики для детей младшего возраста, такие как «Почитаем вместе сказку» с образным изложением материала по бронхиальной астме, которые могут быть реализованы как групповая сказкотерапия и как индивидуальное обучение при активном участии родителей. Особого такта и выдержки необходимо придерживаться при обучении подростков, и течение бронхиальной астмы во многом зависит от адекватности их поведения и систематичности лечения.
Юношеский максимализм и негативизм способствуют отказу от наблюдения и лечения, формированию вредных привычек, таких как курение табака, тем самым расширяют спектр факторов риска. В данной группе неприемлемы обычные формы и методы обучения. Российское исследование продемонстрировало, что подростки считают наиболее привлекательной формой обучения интернет-проекты, тренинги, буклеты, выдержанные в определенном стиле. Для проведения тренингов для подростков необходимо привлечение психолога или обученного психологом врача. Учитывая высокую распространенность курения табака в подростковом возрасте и доказанное отрицательное влияние этой зависимости на течение бронхиальной астмы, все программы для подростков должны обязательно включать обсуждение этого аспекта.
Внедренная 40-минутная методика «Экспресс-профилактики табакокурения у подростков», являющаяся частью проекта «ПАРУС», показала свою высокую эффективность.
В основном перечень обсуждаемых тем близок к таковым в астмашколах для родителей, но может предполагать дополнительно обсуждение таких тем, актуальных для подростков аспектов, как критерии выбора будущей профессии, возможное влияние болезни на здоровье будущих детей, выбор оптимального вида спорта и режима тренировок.
Необходимо подчеркнуть более высокую эффективность лечения при условии образования как всей семьи, так и врачей, среднего медперсонала, педагогов, постоянно занимающихся с ребенком, страдающим бронхиальной астмой. Обучение всех, кто окружает больного ребенка, их сотрудничество на всех этапах позволяет улучшить течение и прогноз заболевания, снизить процент инвалидизации и повысить качество жизни детей, страдающих бронхиальной астмой.
Образовательные программы не должны ограничиваться только отношением врач — родители (врач — пациент). В педиатрии система межличностных контактов значительно раздвигает свои границы и может быть обозначена как: родители — ребенок, ребенок — сверстники, ребенок — воспитатель, учитель, ребенок — медицинский персонал, ребенок — взрослые.
С учетом психологических проблем у многих детей, больных бронхиальной астмой, к работе с ними имеет смысл привлекать специалиста-психолога, владеющего методами индивидуальной и групповой психотерапии и психокоррекции.
Образовательная работа организуется на любых этапах оказания специализированной медицинский помощи ребенку с БА: в региональных детских аллергологических и респираторных центрах, в специализированных санаториях, отделениях восстановительного лечения, что позволяет методически и организационно обеспечить проведение комплексных согласованных лечебно-профилактических мероприятий в условиях конкретного региона, обеспечить продолжительное наблюдение за больными, уменьшить финансовые затраты.
Содержание:
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии