| Новости | e-Образование | Врачебные Общества | Тематические группы | Библиотека | Медиатека | Мероприятия | Атлас |
Присоединяйтесь!
- Повышение квалификации
- Сертифицированное образование
- Актуальные статьи
- Обзоры и репортажи
- Клинические случаи
- Новости медицины
- Советы коллег
Сообщество: Оценка Медицинских Технологий
Клинико-экономическая оценка использования альтернативных вариантов повторного курса противовирусной терапии у пациентов с хроническим гепатитом C, инфицированных вирусом генотипа 1
Клинико-экономическая оценка использования альтернативных вариантов повторного курса противовирусной терапии у пациентов с хроническим гепатитом C, инфицированных вирусом генотипа 1
О.И. Ивахненко, В.В. Омельяновский
Центр оценки технологий в здравоохранении Института прикладных экономических исследований Российской академии народного хозяйства и государственной службы при Президенте РФ, Москва, Россия
Г.Р. Хачатрян
Автономная некоммерческая организация «Национальный центр по оценке технологий в здравоохранении», Москва, Россия
О.Ю. Реброва, И.Г. Никитин
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава РФ, Москва, Россия
Введение
По данным Федерального центра гигиены и эпидемиологии Роспотребнадзора, в РФ в течение последних 10 лет сохраняется устойчивая тенденция к росту заболеваемости хроническим гепатитом С (ХГС) - с 22,2 % в 2000 г. до 40,2 % в 2010 г. (увеличение в 1,8 раза) [1]. В структуре первичной заболеваемости хроническими вирусными гепатитами преобладает ХГС (более 73 %) [2]. Актуальность и значимость проблемы определяется не только распространенностью ХГС в популяции, но и увеличением риска формирования отдаленных неблагоприятных последствий в исходе заболевания - цирроза печени и гепатоцеллюлярной карциномы (ГЦК), что обусловливает финансовое бремя, связанное с оказанием медицинской помощи в долгосрочной перспективе. Даже при неполном охвате нуждающихся в противовирусном лечении в 2008 г. затраты системы здравоохранения РФ на оказание медицинской помощи пациентам с гепатитом С, по оценочным данным, достигли 6,18 млрд руб. [3, 4], а экономическое бремя ГЦК составило для государства в том же году 2,6 млрд руб. [5].
Этиологическая направленность и достижение максимальной эффективности противовирусной терапии (ПВТ) - основная цель стратегии и тактики лечения пациентов с ХГС. Несомненна необходимость ПВТ в предотвращении формирования у пациентов цирротической стадии ХГС, декомпенсации цирроза печени и трансформации его в ГЦК. Однако, несмотря на достижения последних лет, существует категория «трудных» пациентов (ХГС, вызванный вирусом генотипа 1, высокая вирусная нагрузка), у которых проведение одного курса терапии является недостаточным и требуется повторное лечение. Более глубокое понимание молекулярных вирусологических аспектов и патогенеза заболевания существенно улучшили результаты повторных курсов ПВТ в первую очередь благодаря использованию новых подходов к лечению: применение комбинации пегилированных интерферонов и рибавирина в сочетании с ингибиторами протеазы (трехкомпонентная терапия).
Как и для большинства заболеваний, внедрение инновационных подходов к ПВТ является ресурсозатратным. В условиях ограниченных ресурсов здравоохранения возникает необходимость в оптимизации лечения пациентов с ХГС не только с клинической, но и с экономической точки зрения. В связи с этим целью настоящего исследования являлся анализ клинико-экономической целесообразности использования трехкомпонентной ПВТ при проведении повторного курса терапии у пациентов с ХГС, инфицированных вирусом генотипа 1 и не ответивших на предшествующее лечение.
Для достижения цели исследования были решены следующие задачи:
- Разработана математическая модель для оценки кумулятивного числа неблагоприятных событий в исходе ХГС в долгосрочной перспективе в зависимости от выбранной стратегии ведения пациентов с ХГС, инфицированных вирусом генотипа 1 и не ответивших на предшествующее лечение, в зависимости от вида повторного курса ПВТ.
- Рассчитаны затраты на оказание медицинской помощи, включающие расходы на различные варианты ПВТ и издержки на оказание медицинской помощи в результате осложнений в долгосрочной перспективе.
Материалы и методы
Выдвинутая гипотеза исследования основывалась на результатах ранее проведенного клинико-экономического анализа целесообразности ПВТ у пациентов с ХГС [6] и данных сравнительного обзора клинической эффективности и безопасности различных вариантов противовирусного лечения и включала следующие предположения:
- проведение повторного курса ПВТ у пациентов с ХГС, инфицированных вирусом генотипа 1 и не ответивших на предшествующее противовирусное лечение, экономически оправданно, так как приводит к снижению частоты осложнений в исходе ХГС и, как следствие, к сокращению расходов на оказание медицинской помощи в долгосрочной перспективе по сравнению с отсутствием адекватного лечения;
- использование трехкомпонентной терапии при проведении повторного курса ПВТ у данной категории пациентов более эффективно по сравнению с двухкомпонентной ПВТ по критерию частоты достижения устойчивого вирусологического ответа (УВО) и частоты возникновения рецидивов;
- за счет большей частоты достижения УВО и меньшей частоты рецидивов использование трехкомпонентной терапии при проведении повторного курса ПВТ у этих пациентов целесообразнее по сравнению с использованием двухкомпонентной ПВТ.
В настоящем исследовании клинико-экономическая оценка альтернативных подходов к ведению пациентов с ХГС, инфицированных вирусом генотипа 1 и не ответивших на предшествующую терапию, проводилась с использованием методов математического моделирования.
Основная концепция модели заключалась в прогнозировании частоты неблагоприятных осложнений в исходе ХГС в гипотетической когорте пациентов в зависимости от выбранной стратегии:
- без лечения - повторный курс ПВТ указанным пациентам не проводится;
- использование двухкомпонентной терапии - повторный курс ПВТ проводится на основе комбинации пегилированного интерферона и рибавирина;
- использование трехкомпонентной терапии - повторный курс ПВТ проводится на основе комбинации пегилированного интерферона и рибавирина в сочетании с ингибитором протеазы боцепревиром.
Модель основывалась на результатах ранее проведенного анализа доказательств клинической эффективности и безопасности использования альтернативных вариантов ПВТ, который показал следующее [7]:
- Применение боцепревира в комбинации с пегинтерфероном и рибавирином (трехкомпонентная терапия) статистически значимо эффективнее в сравнении с плацебо в комбинации с пегинтерфероном и рибавирином (двухкомпонентная терапия) у пациентов европеоидной расы с ХГС, инфицированных вирусом генотипа 1, у которых предшествующая ПВТ оказалась неэффективна по критерию частоты достижения устойчивого вирусологического ответа: относительная частота (ОЧ) 2,90, 95 % ДИ 1,89-4,72, P < 0,001, X<sudiv>2</sudiv>.
- Применение боцепревира в комбинации с пегинтерферном и рибавирином статистически значимо эффективнее в сравнении с плацебо в комбинации с пегинтерфероном и рибавирином у пациентов любой расы с ХГС, инфицированных вирусом генотипа 1, у которых предшествующая противовирусная терапия оказалась неэффективна по критерию частоты возникновения рецидива: ОЧ 0,36, 95 % ДИ 0,16-0,80, P = 0,022, X<sudiv>2</sudiv>.
Разработка структуры модели и идентификация ключевых параметров для расчетов осуществлялись на основании анализа опубликованных эпидемиологических, клинических и клинико-экономических исследований [8-51].
Исходя из данных научных публикаций, в основу математической модели была положена следующая структура:
- В гипотетической популяции пациентов с ХГС, инфицированных вирусом генотипа 1, проводится курс стандартной ПВТ.
- Затем в группе пациентов, не достигших УВО в ходе проведения стандартной ПВТ, рассматриваются следующие стратегии ведения пациентов:
- без проведения повторной ПВТ;
- с проведением повторного курса противовирусного лечения с использованием стандартного и альтернативного режимов ПВТ, включенных в исследование.
- Для каждой из выбранных стратегий ведения пациентов проводится оценка частоты неблагоприятных исходов (цирроз печени, ГЦК, смерть), полученных в ходе симуляции естественной трансформации ХГС в отдаленной временной перспективе, а именно в течение 25 лет.
При разработке математической модели были приняты следующие допущения:
- для проведения симуляции течения ХГС в модель была включена гипотетическая когорта пациентов (N = 10 000), не ответивших на предшествующее лечение;
- при этом не учитывались особенности предшествующего курса ПВТ (комбинация противовирусных препаратов, длительность лечения, режим дозирования) и клинико-демографические характеристики пациентов (в том числе распределение по возрастам).
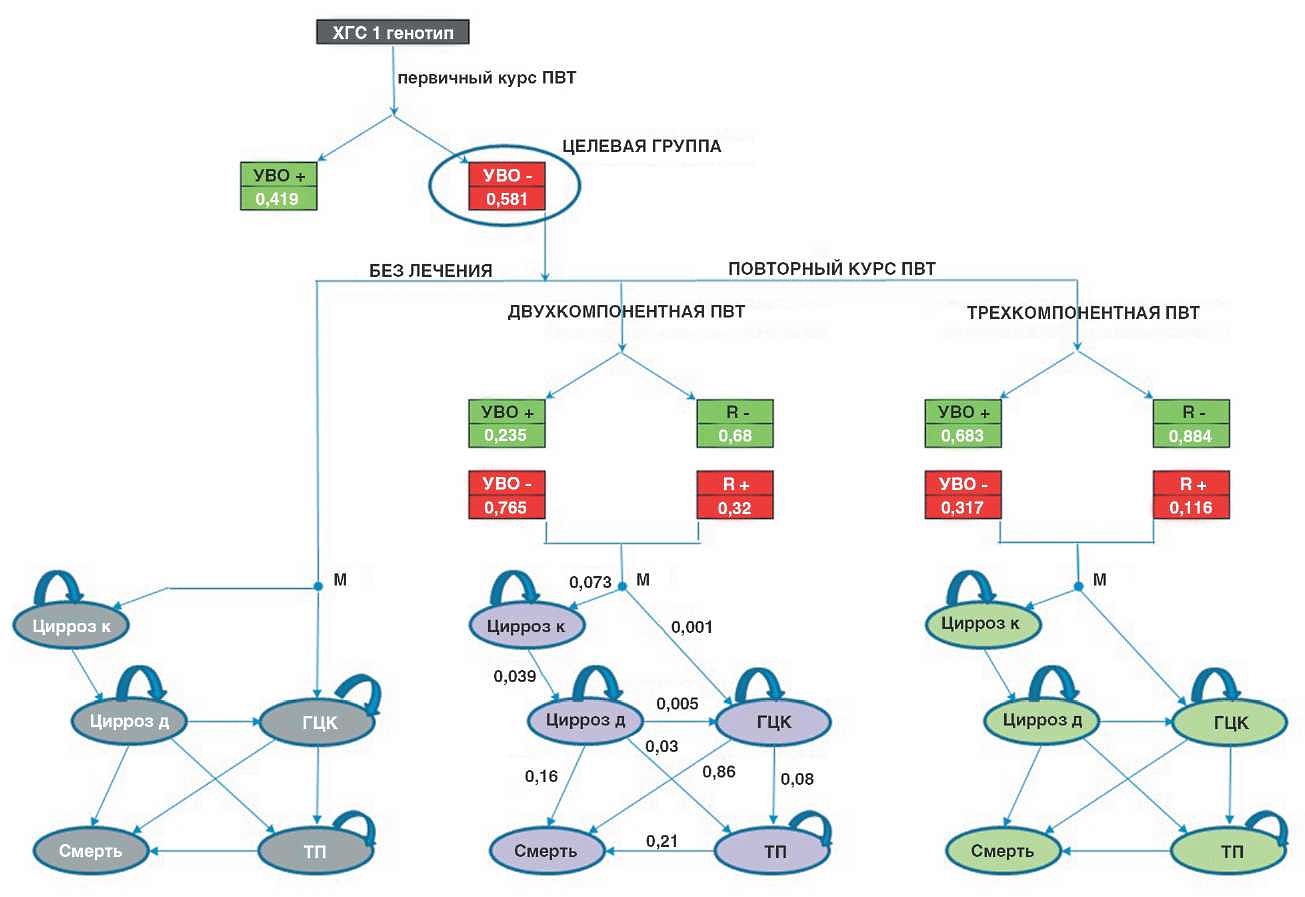
Структура математической модели представлена на рис. 1.
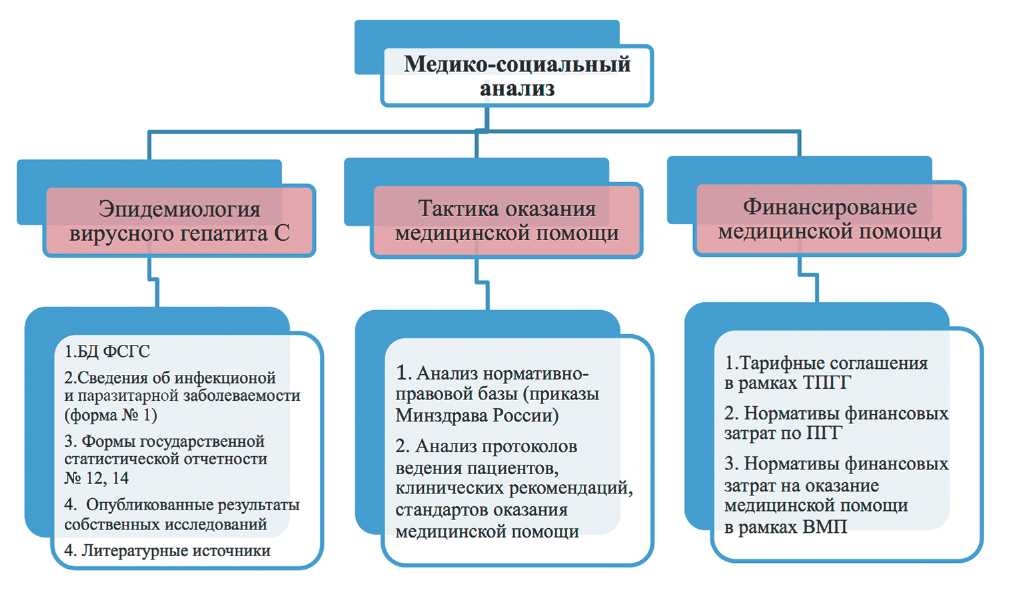
Значения ключевых параметров математической модели были определены на основе анализа данных государственного статистического наблюдения, опубликованных исследований и нормативной документации, регламентирующей оказание медицинской помощи. Алгоритм проведения информационного поиска представлен на рис. 2.
Вероятностные параметры эффективности альтернативных вариантов ПВТ (частота достижения УВО, частота рецидивов) были определены по результатам обзора опубликованных доказательств клинической эффективности и безопасности. Вероятностные параметры трансформации ХГС были идентифицированы на основании анализа результатов зарубежных фармакоэкономических публикаций [25-30]. На сегодняшний день моделирование данных о вероятности проведения трансплантации печени у пациентов с ХГС на стадии компенсированного/декомпенсированного цирроза печени требует дополнительной детализации сведений о распространенности этого вмешательства в популяции пациентов с ХГС в РФ и привлечения соответствующих экспертов (гепатологов, инфекционистов, трансплантологов). В настоящей работе вероятность проведения трансплантации пациентам с ХГС на стадии цирроза печени/ГЦК была смоделирована, исходя из существующих данных государственного статистического наблюдения и данных литературы [5, 49-51].
Экономический анализ для каждой стратегии включал оценку прямых затрат на оказание медицинской помощи в двух временных перспективах:
- в краткосрочной перспективе (на курс лечения) оценивались текущие затраты на проведение ПВТ у пациентов с ХГС;
- в долгосрочной перспективе оценивались затраты на оказание медицинской помощи пациентам с неблагоприятными исходами ХГС.
Рис. 1. Схема математической модели, разработанной для оценки клинико-экономической эффективности двух вариантов повторных курсов ПВТ в сравнении с отсутствием повторного лечения.
Использованные сокращения: R - рецидив; М - марковский цикл (длительность 1 цикла - 1 год, количество циклов - 25); Цирроз к - компенсированный цирроз печени; Цирроз д - декомпенсированный цирроз печени; ТП - трансплантация печени.
Рис. 2. Алгоритм проведения медико-социального анализа. Использованные сокращения: ФСГС - Федеральная служба государственной статистики; ТПГГ - территориальная программа государственных гарантий оказания бесплатной медицинской помощи гражданам РФ; ВМП - высокотехнологичная медицинская помощь.
В расчетах учитывалась длительность повторного курса лечения в течение 48 недель; предполагалось, что повторный курс лечения получают пациенты с ХГС вне стадии цирроза печени. При оценке затрат на повторный курс ПВТ не учитывались особенности ответа на лечение (темпы снижения вирусной нагрузки), позволяющего прогнозировать вероятность достижения УВО и корректировать длительность терапии и целесообразность ее продолжения. Затраты на коррекцию возможных нежелательных явлений на фоне проведения ПВТ не учитывались. Пациентам на стадии цирроза печени затраты на ПВТ не учитывались; также не учитывались затраты на сопутствующее медикаментозное лечение. Пациентам с ГЦК не учитывались затраты на проведение повторных резекций печени. Пациентам с трансплантацией печени не учитывались затраты на противовирусное лечение, а также на повторные трансплантации; учет затрат на трансплантацию печени включал только стоимость самой операции.
Затраты на противовирусные препараты, входящие в состав комбинированной ПВТ, рассчитывались с учетом схем и режимов дозирования, предусмотренных протоколом диагностики и лечения больных вирусными гепатитами и инструкциями по медицинскому применению лекарственных препаратов. В качестве источников информации о ценах на пегинтерферон альфа-2b (ПегИнтрон) и рибавирин были использованы данные отчета Федеральной службы в сфере здравоохранения (Росздравнадзора) «Анализ мониторинга ценовой и ассортиментной доступности лекарственных препаратов за текущий период 2013 г.», а также средняя зарегистрированная цена на эти препараты по регионам РФ. При определении стоимости препарата боцепревир (Виктрелис) учитывалась цена, установленная компанией-производителем и рекомендованная для включения в Перечень жизненно необходимых и важнейших лекарственных препаратов (ПЖНВЛП), и на этом основании была рассчитана предельно допустимая оптовая цена с учетом НДС (10 %) и средней предельно допустимой оптовой надбавки (15 %).
Исходя из стоимости препаратов, схемы лечения и режима дозирования, затраты на комбинированную терапию в расчете на 1 пациента с ХГС в неделю составили:
- комбинация пегинтерферон альфа-2b (ПегИнтрон) + рибавирин - 9873,14 руб.;
- комбинация пегинтерферон альфа-2b (ПегИнтрон) + рибавирин + боцепревир (Виктрелис) - 38 773,14 руб.
Длительность лечения:
- комбинация пегинтерферон альфа-2b (ПегИнтрон) + рибавирин - 48 недель;
- комбинация пегинтерферон альфа-2b (ПегИнтрон) + рибавирин + боцепревир (Виктрелис) - 4 недели (вводный период) используется только пегинтерферон альфа-2b (ПегИнтрон) + рибавирин, в течение последующих 44 недель используется трех-компонентное лечение.
Расчет затрат на оказание медицинской помощи пациентам с ХГС на стадии проведения ПВТ в условиях амбулаторно-поликлинической практики (диспансерное наблюдение) производился на основе данных клинико-экономического анализа «Стоимость отдаленных осложнений хронического гепатита С в РФ», проведенного нами в 2009 г. [3, 4]. В качестве источников информации о ценах для расчета расходов на медицинскую помощь использовались нормативы финансовых затрат на медицинские услуги по тарифам ОМС по Москве за 2013 г.
Таблица 1. Ключевые параметры для расчета затрат на оказание медицинской помощи пациентам с ХГС при проведении противовирусной терапии и лечения осложнений в исходе заболевания в расчете на одного пациента
| Название параметра | Использование | |
|---|---|---|
| Краткосрочная перспектива | ||
| Затраты на проведение повторного курса ПВТ: | Для расчета затрат среди пациентов с ХГС, у которых предшествующая терапия оказалась неэффективной | |
|
473 910,72 | |
|
1 745 510,72 | |
| Затраты на оказание медицинской помощи при проведении ПВТ | 37 217,17 | Для расчета затрат на мониторинг состояния пациента при проведении ПВТ |
| Долгосрочная перспектива (в течение 25 лет) | ||
| Затраты на оказание медицинской помощи пациентам с циррозом печени в исходе ХГС | Для расчета затрат на оказание медицинской помощи при неблагоприятных событиях в исходе ХГС | |
|
214 219,34 | |
|
434 062,63 | |
|
Затраты на оказание медицинской помощи пациентам с ГЦК в исходе ХГС
|
261 601,27 | |
| Затраты на оказание медицинской помощи пациентам при трансплантации печени | 1 425 575 | |
| Затраты на оказание медицинской помощи пациентам в последующий год после трансплантации печени | 612 075,48 | |
Экономический анализ расходов на оказание медицинской помощи пациентам с ХГС на стадии цирроза печени включал оценку прямых медицинских затрат на оказание стационарной медицинской помощи и диспансерное наблюдение пациентов с компенсированным и декомпенсированным циррозом. Определение частоты госпитализации пациентов с ХГС на стадии цирроза печени и объема медицинских услуг в ходе диспансерного наблюдения основывалось на полученных ранее данных экспертного опроса [3]. Для расчета расходов на оказание стационарной медицинской помощи использовались нормативы финансовых затрат на один законченный случай и нормативы финансовых затрат на медицинские услуги по тарифам ОМС по Москве на 2013 г.
Для оценки затрат на оказание медицинской помощи пациентам с ХГС на стадии ГЦК использовались результаты проведенного в НИИ КЭЭФ РНИМУ им. Н. И. Пирогова исследования «Социально-экономическое бремя гепатоцеллюлярной карциномы в РФ» [5]. На основании данных этого исследования были рассчитаны средневзвешенные затраты на оказание медицинской помощи пациентам с ГЦК вне зависимости от стадии заболевания.
На сегодняшний день невозможно оценить тактику ведения пациентов при подготовке к трансплантации, непосредственном проведении трансплантации и в посттрансплантационном периоде без дополнительного изучения объемов оказания медицинской помощи в реальной клинической практике. В связи с этим анализ затрат, сопряженных с этим вмешательством, включал:
- норматив финансирования на проведение трансплантации в рамках оказания высокотехнологичных методов лечения, который составляет 808,5 тыс. руб.;
- затраты на лекарственное обеспечение пациентов после проведения трансплантации в рамках программы «7 нозологий», при этом средняя стоимость рецепта в рамках данной программы определялась по данным мониторинга Росздравнадзора и предполагалось, что в среднем на одного пациента приходится 12 рецептов в год.
Оценка затрат на оказание медицинской помощи пациентам в последующие годы учитывала только расходы на лекарственное обеспечение.
В табл. 1 представлены сводные данные по ключевым параметрам для проведения экономического анализа.
При оценке затрат в рамках длительного промежутка времени учитывался коэффициент дисконтирования [53]:
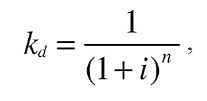
где i - процентная ставка.
Клинико-экономический анализ проводился методом «затраты - эффективность»: рассчитывался инкрементный показатель «затраты/эффект» (показатель приращения эффективности затрат), демонстрирующий дополнительные затраты на одного успешно пролеченного пациента. В качестве критерия оценки экономической приемлемости использовали общее число предотвращенных неблагоприятных исходов (циррозов, гепатоцеллюлярной карциномы, летальных исходов). Методика расчета инкрементного показателя приращения эффективности затрат, отражающего объем дополнительных финансовых вложений на один предотвращенный неблагоприятный исход, приведена в табл. 2.
Таблица 2. Методика расчета инкрементного показателя (ICER) приращения эффективности затрат на один предотвращенный случай неблагоприятного исхода [53]
| Показатель | Сценарий 1 | Сценарий 2 |
|---|---|---|
| Суммарные затраты на оказание медицинской помощи, руб. | Cost1 | Cost2 |
| Число неблагоприятных исходов в когорте, ед. | Qi1 | |
| Разница в затратах, руб. | ACost 1-2 = Cost1-Cost2 | |
| Разница в эффективности | AQi = Qrt_ Qi2 | |
| ICER | ACost 1-2/ AQ= Qi1_ Qi2 | |
Результаты
Естественное течение инфекции, вызванной вирусом гепатита С, складывается из последовательно развивающихся клинических форм заболевания: острый гепатит, хронический гепатит, цирроз печени, гепатоцеллюлярная карцинома.
Данные о прогнозе состояния здоровья у пациентов с ХГС различаются в зависимости от способов построения исследований и включенных в исследование пациентов. По данным систематического обзора эпидемиологических исследований, опубликованного A.J. Freeman и соавт. [10], частота развития цирроза у пациентов с хроническим гепатитом С через 20 лет от начала заболевания составляет: в исследованиях, выполненных в гепатологических клиниках, - 22 % (95 % доверительный интервал (ДИ) 18-26 %); в исследованиях, где объектом изучения являлись инфицированные после гемотрансфузии, - 24 % (95 % ДИ 11-37 %); у инфицированных доноров - 4 % (95 % ДИ 1-7 %); в исследованиях, выполненных на репрезентативных выборках из населения, - 7 % (95 % ДИ 4-10 %). Более быстрое прогрессирование болезни связано с такими факторами как старший возраст в момент инфицирования, мужской пол и злоупотребление алкоголем. Высокий риск развития цирроза, выявленный среди пациентов гепатологических клиник, может быть результатом смещенного отбора. Авторы обзора делают заключение, что у заразившегося вирусом гепатита С молодого человека риск развития цирроза через 20 лет составляет не более 10 % [11].
Аналогичные данные были получены в метаанализе H.H. Thein с соавт. (2008 г.): для всех 111 исследований, включенных в метаанализ, частота развития цирроза через 20 лет после инфицирования составляла 16 % (95 % ДИ 14-19 %) и колебалась от 7 % (4-12 %) в исследованиях, проведенных вне специализированных клиник (например, изучавших прогноз у случайно выявленных инфицированных доноров крови), до 18 % (15-21 %) в ретроспективных перекрестных исследованиях, выполненных на базе специализированных гепатологических центров [12]. Анализ данных литературы позволяет говорить, что в среднем у 20 % больных, не получавших ПВТ, в течение 20-30 лет развивается цирроз печени, причем на скорость его развития влияет ряд факторов (факторы хозяина) [9-24].
Отсутствие единой системы учета результативности проведения ПВТ ХГС не позволяет объективно оценить распространенность инфицированности вирусом гепатита С, заболеваемости ХГС и частоту развития неблагоприятных исходов. По данным государственного статистического наблюдения также трудно проанализировать частоту встречаемости состояний, являющихся отдаленными осложнениями ХГС. Помимо этого серьезным препятствием при проведении фармакоэкономического анализа в условиях системы здравоохранения РФ является отсутствие систематизированных данных об объемах медицинской помощи больным на разных стадиях ХГС и ее стоимости, в связи с чем необходимо подробное изучение современной тактики ведения отдельных состояний как на амбулаторном этапе, так и в стационаре с определением структуры расходов и ее соответствия клинической ситуации [54]. Вследствие выше указанных причин довольно проблематично провести полноценный анализ социально-экономического бремени ХГС в части прямых медицинских затрат на оказание медицинской помощи в исходе заболевания в долгосрочной перспективе. В связи с этим наиболее оптимальным вариантом решения данной проблемы является использование методов математического моделирования, позволяющих провести симуляцию течения ХГС и спрогнозировать частоту неблагоприятных исходов заболевания в долгосрочной перспективе в зависимости от выбранной тактики ведения пациентов с ХГС.
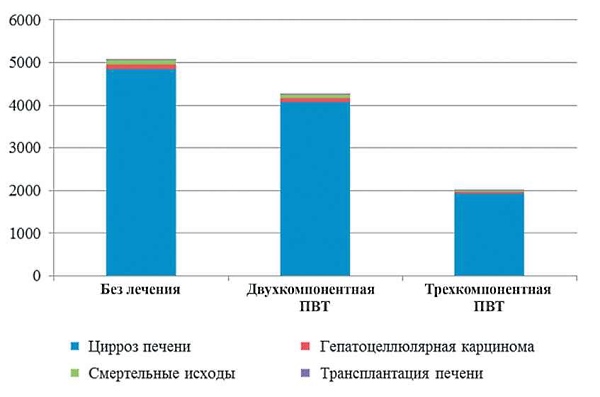
Рис. 3. Кумулятивная частота неблагоприятных событий в исходе ХГС при оценке в долгосрочной перспективе (за 25 лет) при различных стратегиях ведения пациентов.
В настоящем исследовании была разработана соответствующая математическая модель, основу которой составила схема естественного течения заболевания - прогрессирование ХГС до цирротической стадии, трансформация цирроза печени в ГЦК. Полученные с помощью этой модели данные использовались для дальнейшей оценки затрат на оказание медицинской помощи пациентам с ХГС в исходе заболевания.
Как показали результаты обзора зарубежных фармакоэкономических исследований [25-30], выбранный нами метод вполне соответствует и не противоречит принятым в международной практике подходам к оценке экономической целесообразности применения альтернативных вариантов ПВТ при ХГС.
Согласно разработанной нами математической модели, в гипотетической когорте из 10 000 пациентов с ХГС, инфицированных вирусом генотипа 1, число пациентов, не ответивших на первичный курс ПВТ, должно составить 5810 человек - такова целевая группа для проведения повторного курса лечения.
В рамках модели были проанализированы клинические и экономические результаты трех альтернативных стратегий ведения пациентов с ХГС в долгосрочной перспективе. Полученные данные показали, что с клинической точки зрения проведение повторного курса ПВТ у пациентов с ХГС, инфицированных вирусом генотипа 1, не ответивших на предшествующую терапию, вполне оправданно, так как частота неблагоприятных исходов снижается (рис. 3):
- в случае повторного лечения на основе двухкомпонентной ПВТ - на 16,03 %;
- в случае использования трехкомпонентной ПВТ - на 60,38 %.
За счет большей клинической эффективности ПВТ на основе комбинации пегилированного интерферона и рибавирина в сочетании с боцепревиром (трехкомпонетная терапия) можно предотвратить большее число осложнений не только по сравнению со стратегией без лечения, но и в сравнении с ПВТ на основе пегилированного интерферона и рибавирина. Снижение частоты неблагоприятных событий в исходе ХГС в результате проведения повторного курса ПВТ должно привести и к сокращению суммарных затрат на оказание медицинской помощи в случаях развития осложнений.
Суммарные затраты на оказание медицинской помощи в краткосрочном периоде и долгосрочной перспективе в зависимости от выбранной стратегии ведения пациентов целевой группы представлены в табл. 3.
Таблица 3. Общие прямые затраты на оказание медицинской помощи в краткосрочном периоде и долгосрочной перспективе в зависимости от выбранной стратегии ведения пациентов целевой группы
| Стратегия ведения пациентов с ХГС | |||
|---|---|---|---|
| без лечения | двухкомпонентная ПВТ | трехкомпонентная ПВТ | |
| _ | 2 969 653 041 | 10 127 281 611 | |
| 8 836 748 398 | 7 424 636 004 | 3 501 367 144 | |
| 8 836 748 398 | 10 394 289 045 | 13 628 648 756 | |
| Референтная терапия | 1 557 540 647 | 4 791 900 358 | |
Таблица 4. Сравнительная клинико-экономическая оценка возможных вариантов ведения пациентов целевой группы (пациенты с ХГС, не ответившие на предшествующее лечение)
| Стратегия ведения пациентов | |||
|---|---|---|---|
| без лечения | двухкомпонентная ПВТ | трехкомпонентная ПВТ | |
| 5075 | 4262 | 2012 | |
| Референтная терапия | 813 | 3063 | |
| 8 836 748 398 | 10 394 289 045 | 13 628 648 756 | |
| Референтная терапия | 1 557 540 647 | 4 791 900 358 | |
| Референтная терапия | 1 914 866,61 | 1 564 303,60 | |
Согласно полученным результатам, «экономия» средств на проведение повторного курса ПВТ приводит к росту затрат на оказание медицинской помощи при неблагоприятных исходах вследствие ХГС. В случае же проведения повторного курса ПВТ в целевой группе пациентов затраты на оказание медицинской помощи в долгосрочной перспективе сокращаются в пределах от 1,41 до 3,92 млрд рублей. Однако это сокращение будущих затрат не компенсирует стоимости повторного курса ПВТ; иными словами, альтернативные стратегии проведения повторного курса ПВТ являются затратными технологиями. Так, в расчете на целевую группу выбор одного из альтернативных вариантов ПВТ потребует финансового обеспечения в размере от 2,96 млрд руб. в случае назначения двух-компонетной терапии до 10,13 млрд руб. при использовании трехкомпонентной комбинации.
Объем дополнительных вложений на предотвращение одного неблагоприятного события (цирроз печени, ГЦК, смерть) составил:
- в случае использования двухкомпонентной ПВТ -1 914 866,61 руб.;
- в случае использования трехкомпонентной ПВТ -1 564 303,60 руб.
На основании полученных данных можно сделать вывод о том, что проведение повторного курса ПВТ с использованием трехкомпонентной комбинации - наиболее оптимальный вариант как с экономической, так и с клинической точки зрения в сравнении с использованием только пегилированного интерферона и рибавирина.
Следует признать, что на сегодняшний день проблемы учета заболеваемости и смертности от ХГС не позволяют провести точную оценку потерь для общества, связанных с этим заболеванием, и являются одной из причин того, что экономические последствия заболевания анализируются только с позиций системы здравоохранения. Регистрация инфекции, вызванной вирусом гепатита С, в рамках государственного статистического наблюдения была внедрена в России с 1994 г. Официальному учету подлежат: первичная заболеваемость острым и хроническим гепатитом С, так называемое «носительство», летальность от острого гепатита С. С момента начала регистрации кумулятивное число больных ХГС нарастает и, как следствие, увеличивается число лиц, нуждающихся в длительной и дорогостоящей ПВТ. По мере увеличения популяции больных ХГС с длительностью заболевания более 20 лет ожидается и рост частоты неблагоприятных исходов, и сдвиг высоких показателей заболеваемости ХГС от возрастной группы 21-39 лет к возрастной группе 41-59 лет. Наряду с другими факторами (пути передачи, коинфекция с ВИЧ, частота распространения в популяции трудоспособного возраста, в особенности среди молодежи, определяющей демографический рост страны) именно спектр неблагоприятных исходов в основном определяет социально-экономическую значимость гепатита С. С этой точки зрения ХГС относится к тем нозологиям, которые требуют всестороннего анализа их экономического бремени. Прежде всего это касается оценки экономических потерь вследствие утраты трудоспособности и преждевременной смерти, причем издержки общества, обусловленные состоянием пациента на стадии осложнений ХГС, могут превышать годовые расходы системы здравоохранения на проведение ПВТ. Таким образом, можно предположить, что дополнительный объем финансовых издержек на одного успешно пролеченного пациента с ХГС в значительной мере нивелируется.
Выводы
- По данным моделирования, в гипотетической когорте из 10 000 пациентов с ХГС, инфицированных вирусом генотипа 1, число пациентов, не ответивших на первичный курс ПВТ, т.е. являющихся целевой группой для проведения повторного курса лечения, составляет 5810 человек. В течение 25 лет в этой группе общее ожидаемое число неблагоприятных исходов составит:
- в отсутствие лечения - 5075 случаев;
- при проведении повторного курса ПВТ на основе двухкомпонентной комбинации - 4262 случая (снижение на 16,03 % по сравнению с отсутствием лечения);
- при проведении повторного курса ПВТ на основе трехкомпонентной комбинации - 2012 случаев (снижение на 60,38 % по сравнению с отсутствием лечения).
- Затраты на повторный курс ПВТ составят 0,473 млн рублей и 1,745 млн рублей на одного пациента при использовании двухкомпонетной (пегилированный интерферон + рибавирин) и трехкомпонентной (пегилированный интерферон+ рибавирин + боцепревир) терапии, соответственно, что в расчете на целевую группу, включенную в анализ (5810 пациентов), приведет к расходам в размере 2,97 и 10,13 млрд руб.
- В долгосрочной перспективе проведение повторного курса лечения у пациентов с ХГС, не ответивших на предшествующую терапию, позволяет существенно сократить затраты на оказание медицинской помощи, связанные с формированием неблагоприятных последствий в исходе ХГС. В зависимости от стратегии ведения целевой группы пациентов затраты на оказание медицинской помощи, связанные с неблагоприятными последствиями в исходе ХГС, в долгосрочной перспективе составят:
- в отсутствие лечения - 8,83 млрд руб.;
- при проведении повторного курса ПВТ на основе двухкомпонентной комбинации - 7,42 млрд руб.;
- при проведении повторного курса ПВТ на основе трехкомпонентной комбинации - 3,50 млрд руб.
- Объем дополнительных вложений на предотвращение одного неблагоприятного события (цирроз печени, ГЦК, смерть) составляет:
- в случае использования двухкомпонентной ПВТ -1 914 866,61 руб.;
- в случае использования трехкомпонентной ПВТ -1 564 303,60 руб.
Заключение
Проведение повторного курса ПВТ в популяции пациентов с ХГС, инфицированных вирусом генотипа 1, не ответивших на предыдущее лечение, экономически оправданно. Как с клинической, так и с экономической точки зрения, оптимальным вариантом является использование трехкомпонентной комбинации - пегилированного интерферона и рибавирина в сочетании с боцепревиром - в сравнении с использованием только пегилированного интерферона и рибавирина.
Литература:
1. Государственный доклад «О санитарно-эпидемиологической обстановке в Российской Федерации в 2010 году». - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2011. - 431 с.
2. Сведения об инфекционных и паразитарных заболеваниях (Форма №1) за январь-декабрь 2010 г. http://rospotrebnadzor.ru/ epidemiologicsituation
3. Отчет «Стоимость отдаленных осложнений хронического гепатита С» НИИ клинико-экономической экспертизы и фармакоэкономики РНИМУ им. Н.И. Пирогова. 2009 г. [неопублик.].
4. Omelyanovsky V., Avksentieva M . , Krysanov I., Ivakhnenko O. Hepatitis C burden in Russia. Value in Health. 2010; 13 (7).
5. Базин И.С., Омельяновский В.В., Авксентьева М.В., Крысанов И.С., Ивахненко О.И. Анализ социально-экономического бремени гепатоцеллюлярной карциномы в России. Медицинские технологии: оценка и выбор. 2010; №2: 22-27.
6. Омельяновский В.В., Горяйнов С.В., Ивахненко О.И, Цфасман Ф. М. Сравнительный клинико-экономический анализ комбинированных режимов противовирусной терапии хронического гепатита С. Возмещаемые лекарственные средства. М.: 2009. - С. 97-108.
7. Bacon B.R., Gordon S.C., Lawitz E., et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med. 2011 Mar 31; 364 (13): 1207-1217.
8. Blackard T.J., Tarek Shata М., Shire J.N., Sherman E. K. Acutehepatitis C virus infection: achronic problem. Hepatology. January 2008: 321-331.
9. Fattovich G., Pantalena M., Zagni I., et al. Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis: a cohort study of 297 patients. Am J Gastroenterol. 2002; 112: 463-472.
10. Freeman A.J., Dore G.L., Law M.G., et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology. 2001; 34: 809-816.
11. Thein H.H., Yi Q., Dore G.J., Krahn M.D. Estimation of stage-specific Abrosis progression rates in chronic hepatitis C virus infection: a meta-analysis and meta-regression. Hepatology. 2008; 48 (2): 418-431.
12. Alter H.J., Seeff L.D. Recovery, persistence, and sequelae in hepatitis C virus infection: aperspective on longterm outcome. SEMINARS IN LIVER DISEASE, 2000; v. 20, №1: p. 17-20.
13. Kayali Z., Buckwold V.E., Zimmerman B., Schmidt W.N. Hepatitis C infection, cryoglobulinemia, and cirrhosis: a meta-analysis. Hepatology. 2002; 36: 978-985.
14. Niederau C., Lange S., Heintges T., et al. Prognosis of chronic hepatitis C: results of a large, prospective cohort study. Hepatology. 1998; 28: 1687-1695.
15. Poynard T., Bedossa P., Opolon P., for the OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups. Natural history of liver fibrosis progression in patients with chronic hepatitis C. Lancet. 1997; 349: 825-832.
16. Chen S.L., Morgan T.R. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006; 3 (2): 47-52.
17. Zaltron S., Spinetti A., Biasi L., Baiguera C., Castelli F. Chronic HCV infection: epidemiological and clinical relevance. BMC Infectious Diseases. 2012; 12 (Suppl.2): S2. http://www.biomedcentral. com/1471-2334/12/S2/S2
18. Варикозно расширенные вены пищевода. Практические рекомендации Всемирной гастроэнтерологической организации. World Gastroenterology Organisation, 2008.
19. Диагностика и лечение диффузных заболеваний печени. Методическое пособие для врачей, руководителей органов управления здравоохранением и лечебно-профилактических учреждений. Под ред. В.Т. Ивашкина и Н.Д. Ющука . http://www. gastrosite.ru/articles/article.aspx?id=2109#virus2
20. Лечение осложнений цирроза печени (методические рекомендации для врачей). РЖГГК. 2009. Т.19; №1: 78-86. http:// www.gastro-j.ru/article/66-lechenie-oslozhneniy-tsirroza-pecheni-metodicheskie-rekomendatsii-dlya-vrachey-br/
21. Лечение асцита, осложняющего цирроз у взрослых. Практическое руководство Всемирной организации гастроэнтерологов (ВОГ-OMGE). http://www.hcv.ru/articles/stat/ascit-wgo2010.html
22. Лобзин Ю.В., Гусев Д.А., Чирский В.С., Карев В.Е., Луцкий А. А. Морфологическая характеристика естественного течения хронической HCV-инфекции при различных темпах прогрессирования заболевания. Вестник Санкт-Петербургского университета, 2008; сер. 11, вып. 4. - 91-101.
23. Ивашкин В. Т., Маевская М.В. Лечение осложнений цирроза печени: методические рекомендации для врачей. М.: Литтерра; 2011. - 64 с. http://www.mucofalk.ru/download/ivashkin-mayevskaya-cirrhosis.pdf
24. Современное состояние проблемы цирроза печени. Протокол бюро отделения клинической медицины РАМН от 25.09.2008 г. РЖГГК. 2009; №1: 87-88.
25. Siebert U., Sroczynski G., Rossol S., et al. Cost effectiveness of peginterferon alpha-2b plus ribavirin versus interferon alpha-2b plus ribavirin for initial treatment of chronic hepatitis C. Gut, 2003 Mar; 52 (3): 425-432.
26. Salomon J., et al. Cost-effectiveness of treatment for chronic hepatitis C infection in an evolving patient population. JAMA. 2003; 290 (2): p. 228.
27. Sullivan S.D., et al. Cost effectiveness of peginterferon alpha-2a plus ribavirin versus interferon alpha-2b plus ribavirin as initial therapy for treatment-naive chronic hepatitis C. PharmacoEconomics. 2004; 22 (4): 257-265.
28. Younossi Z., et al. Cost effectiveness of interferon 2b combined with ribavirin for the treatment of chronic hepatitis C. Hepatology. 1999; 30 (5): 1318-1324.
29. Davis G., Albright J., Cook S., Rosenberg D. Projecting future complications of chronic hepatitis C in the United States. Liver Transplantation. 2003; 9 (4): 331-338.
30. Wong J., McQuillan G., Mc Hutchinson J., Poynard T. Estimating future hepatitis C morbidity/mortality and costs in the United States. American journal of public health. 2000; 90 (10): 1562-1568.
31. Российское общество по изучению печени. Российская гастроэнтерологическая ассоциация. Алгоритм обследования и лечения больных хроническим гепатитом С. Ведение больных с побочными действиями противовирусных препаратов. Рекомендации для врачей. http://www.liver.ru/1_34_546_547
32. Гепатит С и ВИЧ-инфекция: тактика ведения пациентов с сочетанной инфекцией. Клинический протокол для Европейского региона ВОЗ. ВОЗ: 2006.
33. Диагностика и лечение гепатита С. Рекомендации Американской гепатологической ассоциации 2004 г. http://www.hcv.ru/ standarts/part1.htm
34. Абдурахманов Д. Т. Противовирусная терапия хронического гепатита С: пришло ли время менять существующие стандарты? Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2009; № 1: 16-21.
35. Блохина Н.М. Рациональные подходы к лечению хронического гепатита С. Материалы научно-практической конференции «Инфекционные болезни и антимикробные средства». Москва, 6-7 октября 2003. www.hepatit.ru/confs/infec_bolezn_konf.doc
36. Жданов К.В., Гусев Д.А, Рысев А.В., Павлович Д.А., Загашвили И. В., Сахонь Н.Г., Сапегин А.А., Красиков Е.К., Курчиков А.Г., Кордюков И.В. Клиника, диагностика и лечение латентных форм вирусных гепатитов В и С. Terra Medica. 2004; №3: 39-42.
37. Ивашкин В. Т. Диагностика, лечение и ведение пациентов с гепатитом С. Методические рекомендации (по материалам практических рекомендаций Американской ассоциации общества по изучению заболеваний печени). Клиническая микробиология и антимикробная химиотерапия. 2006. Т. 8; № 2: 102-129.
38. Ильина Е.Н., Фомина Е.Е., Артемов Е.К., Говорун В.М., Иваников И.О., Сюткин В.Е. Хронические вирусные заболевания печени. Методическое пособие для врачей. Москва: 2001. - 22 с. http://www.lytech.ru/data/file/zabol-pecheni.pdf.
39. Козлов В.К., Стельмах, В.В. Радченко В.Г. HCV-инфекция: современная стратегия комплексного лечения. Пособие для врачей. Санкт-Петербург: 2008. - 91 с.
40. Козлов В.К., Стельмах В.В. Радченко В.Г. Современная стратегия комплексного лечения больных хроническими вирусными гепатитами: направления и средства, эффективность, перспективы оптимизации. Тезисы «Объединенного иммунологического форума». Санкт-Петербург, 2008. Российский иммунологический журнал. 2008. Т. 2 (11); № 2-3: 266.
41. Никитин И.Г. Лечение гепатита С: вчера, сегодня, завтра. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2002; № 6: 11-16.
42. Sulkowski M.S. Final results of the IDEAL (individualzed dosing efficacy versus flat dosing to assess optimal pegylated interferon therapy) phase IIIb study. J. Hepatology. 2008; 48 (Suppl. 2): A. 991.
43. Sulkowski, M. Probability of sustained virologic response is associated with the magnitude of HCV RNA reduction at week 4 of treatment with peginterferon plus ribavirin: results of the IDEAL trial. J Hepatology. 2008; 48: A. 1868.
44. Sulkowski, M. Treatment-related anemia but not epoetin use is associated with higher SVR rates among persons treated with peginterferon/ribavirin: results from the IDEAL study. J Hepatology. 2008; 48: A. 1851.
45. McHutchison J., Manns M., Patel K.,et al. Adherence to combination therapy enhances sustained response in genotype-1-infected patients with chronic hepatitis C. Gastroenterology. 2002; 123: 1061-1069.
46. McHutchison J., Sulkowski M. Scientific rationale and study design of the individualized dosing efficacy vs flat dosing to assess optimal pegylated interferon therapy (IDEAL) trial: determining optimal dosing in patients with genotype 1 chronic hepatitis C. J. Viral Hepat. 2008; 15: 475-481.
47. McCone J., Hu K., McHutchison J., at al. Sustained virologic response and predictors of response in africanamerican patients in the IDEAL (individualized dosing efficacy versus flat dosing to assess optimal pegylated interferon therapy) phase 3b study,.J Hepatology. 2008; 48: 268.
48. Бурневич Э.З. Уроки исследования IDEAL. Журнал инфектологии. 2010; №1: 66-74.
49. Готье С.В., Мойсюк Я.Г., Хомяков С.М., Ибрагимова О.С. Развитие органного донорства и трансплантации в Российской Федерации в 2006-2010 гг. III сообщение регистра Российского трансплантологического общества. Вестник трансплaнтологии и искусственных органов. 2011; № 2: 6-21. http://www.transpl. ru/uploaded/Transpl_2_2011_web.pdf
50. Готье С.В., Мойсюк Я.Г., Попцов В.Н и соавт. Опыт 100 трансплантаций трупной печени в одном центре. Вестник трансштантологии и искусственных органов. 2012; № 1: 6-15. http://www. transpl.ru/uploaded/vestnik_1_2012_web.pdf
51. Хазанов А.И., Васильев А.П., Пехташев А.Г., Некрасова Н.Н., Плюснин С.В., Скворцов С.В. Значение основных и добавочных этиологических факторов развития НCV- и НBV-циррозов печени. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2001; №4: 8-12.
52. Ярошенко Е.Б., Бурневич Э.З., Мойсюк Е.Г. Роль вирусных гепатитов в развитии гепатоцеллюлярной карциномы. Практическая онкология. 2008; 9 (4): 189-193.
53. Клинико-экономический анализ. Под ред. П. А. Воробьева. М.: Ньюдиамед; 2008. - 778 с.
54. Ющук Н.Д., Знойко О.О., Дудина К.Р., Зайратьянц О.А., Евдокимова А.И., Остроумова А.А., Якушечкина Н.А. Проблемы учета заболеваемости и смертности от хронического гепатита С в Российской Федерации. Здравоохранение. 2012; №12: 68-74.
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии