| Новости | e-Образование | Врачебные Общества | Тематические группы | Библиотека | Медиатека | Мероприятия | Атлас |
Присоединяйтесь!
- Повышение квалификации
- Сертифицированное образование
- Актуальные статьи
- Обзоры и репортажи
- Клинические случаи
- Новости медицины
- Советы коллег
Сообщество: Оценка Медицинских Технологий
Модель образования общей резистентности микроорганизма к антимикробным средствам
М.А. Арепьева, А.С. Колбин
Санкт-Петербургский государственный университет, Россия
С.В. Сидоренко
ФГБУ «Научно-исследовательский институт детских инфекций Федерального медико-биологического агентства», Санкт-Петербург, Россия
Е.Н. Колосовская
ГУЗ «Медицинский информационно-аналитический центр», Санкт-Петербург, Россия
Актуальность
Резистентность возбудителей инфекционных заболеваний к антибиотикам - крайне важная проблема современного здравоохранения. Полностью предотвратить формирование и распространение резистентности у микроорганизмов невозможно, поскольку этот феномен является одним из проявлений фундаментального свойства всего живого - способности адаптироваться к изменяющимся условиям окружающей среды. В настоящее время усилиями современной медицины и биологии удается лишь ограничивать распространенность данного явления. Представляется, что более эффективному его контролированию может способствовать следующее: построение - на основе математических методов и инструментов - алгоритмов прогнозирования распространения резистентности; выявление причин снижения/увеличения резистентности; определение времени для перехода на другие противоинфекционные средства [1-3]. Однако соответствующих исследований и в Российской Федерации и в мире проводится недостаточно.
В связи с этим целью настоящей работы было построение функции прогнозирования развития резистентности E.coli к антибиотикам с течением времени. Дополнительной целью была классификация антимикробных средств по критерию влияния на возникающую к ним резистентность.
Материалы и методы
Микробиологический мониторинг в Санкт-Петербурге (СПб) организован в виде двухуровневой системы (локальной и региональной). В 2003-2007 гг. была сформирована локальная система микробиологического мониторинга в государственных учреждениях здравоохранения (ГУЗ) стационарного типа, имеющих в своем составе бактериологические лаборатории. Требования к организации такой системы с использованием компьютерной аналитической программы WHONET изложены в распоряжении Комитета по здравоохранению «О внедрении микробиологического мониторинга как элемента инфекционного контроля в государственные учреждения здравоохранения стационарного типа» от 29 декабря 2004 г. №405-P.
Локальная система микробиологического мониторинга со сформированной (с помощью компьютерной программы WHONET) электронной базой данных, описывающих выделенных возбудителей госпитальных инфекций, охватывает: 7 из 13 лабораторий многопрофильных стационаров; 4 из 5 лабораторий детских стационаров; 2 из 4 лабораторий специализированных стационаров; 3 из 10 учреждений родовспоможения. С 2008 г. работает первая в РФ региональная система микробиологического мониторинга - общегородская база данных чувствительности/резистентности микроорганизмов к противоинфекционным средствам, сформированная из данных, предоставляемых ГУЗ СПб в формате файлов компьютерной программы WHONET. В настоящее время общегородская база содержит данные результатов определения чувствительности 49 687 штаммов микроорганизмов к антибиотикам, выделенных в лабораториях двенадцати ГУЗ стационарного типа (семь многопрофильных стационаров, два детских стационара, один специализированный стационар и два учреждения родовспоможения).
Материалом настоящего исследования послужили результаты мониторинга одного многопрофильного стационара за 6 лет (с 2007 по 2012 гг.), представленные в базе данных микробиологического мониторинга по СПб. Использовались следующие данные: количество пациентов с положительным анализом на E.coli, получавших лечение в стационаре; результаты оценки резистентности микроорганизма (в процентах от количества взятых анализов), полученные диск-диффузионным методом. Данные по числу пациентов и результатам оценки резистентности были сгруппированы помесячно. Информацию по диагнозу в исследование не включали.
Механизм приобретения резистентности E.coli к антимикробным средствам
Информационно-логическая модель образования резистентности
Была рассмотрена эволюция популяции E.coli за некоторый период времени. Популяция бактерий, включенных в исследование, обладала природной чувствительностью к использованным антибиотикам. Однако к этим средствам возможно формирование и дальнейшее распространение приобретенной устойчивости.
Таким образом, в реальных условиях популяция бактерий состоит из двух субпопуляций: «дикой», лишенной приобретенной устойчивости, и «недикой», обладающей такой устойчивостью. Можно предположить, что соотношение этих субпопуляций будет определяться двумя разными составляющими. Первой из них является относительно стабильная доля недикой субпопуляции, которая определяется некоторым постоянным уровнем применения антибиотиков в медицине, ветеринарии и сельском хозяйстве. Вторая составляющая отражает краткосрочное изменение доли недикой популяции в результате случайных изменений внешних условий.
При подобной модели распространение резистентных штаммов первой составляющей будет происходить довольно медленно. При долгосрочном наблюдении такой популяции можно отследить динамику изменения ее резистентности с течением времени. Другими словами, фиксируя все влияющие на резистентность факторы (кроме времени) на некотором постоянном уровне (принимая их за константы), мы получаем чистую зависимость резистентности от времени. Такая резистентность известна как фоновая.
Однако реальные условия далеки от идеальных, так что, помимо времени, на образование резистентности влияют и другие факторы (в нашем случае - количество пациентов, проходивших лечение за рассматриваемый период, тактика и стратегия антибактериальной терапии). При этом оказываемые эффекты крайне вариабельны по своей выраженности, из-за чего могут происходить существенные кратковременные изменения в доле недикой популяции. Чистая зависимость резистентности от всех остальных факторов (кроме времени) была названа энтропией резистентности (ЭР).
Резюмируя сказанное, приведем следующие определения выделенных типов резистентности:
- общая резистентность (ОР) - фактическая доля резистентных штаммов на момент проведения анализов чувствительности к антибиотику. Определяется как сумма фоновой, естественной и энтропийной резистентности;
- естественная резистентность (ЕР) - условный минимальный уровень фоновой резистентности на момент начала сбора данных;
- фоновая резистентность (ФР) - плавно меняющаяся с течением времени составляющая общей резистентности, обусловленная естественными эволюционными процессами и естественным обменом штаммами среди населения.
- энтропийная резистентность (ЭР) - составляющая общей резистентности, формирующаяся в результате относительно краткосрочных, но интенсивных изменений в окружающей среде (грубые нарушения гигиенического режима, принципиальные изменения тактики антибактериальной терапии, появление новых механизмов резистентности).
Стоит принять во внимание тот факт, что ЭР отражает текущее влияние, оказываемое как применением антимикробного средства, так и эпидемиологической ситуацией. Следовательно, если в рамках образования ЭР формируется новый резистентный штамм и впоследствии он обнаруживает хорошую способность к выживанию в течение длительного времени (не подавляется антибиотиком), то такой штамм будет относиться уже к ФР. Таким образом, часть ЭР в некотором смысле перетекает в ФР.
Энтропийная резистентность является главным управляемым параметром. Управляемость достигается благодаря возможности назначать или не назначать препарат, регулировать частоту и объемы его применения, а также искусственно регулировать плотность больных в регионе (при уменьшении числа пациентов снижается вероятность перехода резистентных штаммов от одного больного к другому). Фоновая резистентность (неуправляемый параметр) служит основным критерием оценки долгосрочной эффективности с точки зрения скорости образования фоновой резистентности к антибиотикам.
Первичная обработка данных
Для корректного анализа собранных данных необходимо было отобрать наблюдения в соответствии со следующими требованиями:
- наблюдения резистентности микроорганизма к определенному антибиотику за исследуемый интервал времени должны быть непрерывными;
- данные этих наблюдений для каждого временного интервала должны быть достаточными, чтобы построить и проверить модель развития резистентности.
Как показал анализ динамики резистентности в нескольких крупных стационарах, указанным требованиям соответствовал только один стационар.
В ходе мониторинга наибольшее количество наблюдений было собрано по Exoli, Klebsiella pneumoniae, Staphylococcus aureus. Данные о других патогенных бактериях либо отсутствовали за несколько периодов, либо были недостаточны. В настоящей статье математическая модель описана на основе данных по Exoli.
Этапы формирования математической модели Формирование математической модели включало 4 этапа.
- Общую резистентность (R) определяли помесячно как резистентность за рассматриваемый период. Также ежемесячно учитывали количество пациентов, проходивших лечение в стационаре. Каждому месяцу присваивали порядковый номер, т. е. первый месяц мониторинга - «временной период 1», второй месяц - «временной период 2» и так далее. Таким образом был сформирован набор данных по каждому периоду: (R%, t, n), где t - порядковый номер месяца, %R - факт резистентности за период t, n - количество пациентов за период t.
- Далее на части данных было проведено обучение модели (подбор коэффициентов входных параметров для функциональной зависимости ФР, при которых достигается наиболее точное соответствие аппроксимационной функции и описываемых ею исторических данных).
- Была проведена проверка адекватности модели на тестовых данных (не участвующих при нахождении коэффициентов).
- Выполнена корректировка модели.
Математическая модель
Прежде всего, для нахождения ФР была произведена очистка общей резистентности (ОР) от всех влияний, за исключением времени:
ФР = А• ln(t),
где A - минимальная скорость изменения ОР, полученная при усреднении прочих параметров. При этом исходили из предположения о равномерном потреблении антибиотиков и постоянстве эпидемиологической ситуации на всем исследуемом промежутке времени. Из-за плавного роста уровня резистентности с течением времени было решено смоделировать изменение ФР с помощью логарифмической функции. Главной задачей было зафиксировать параметры, влияющие на изменение резистентности и проследить за ростом резистентности только в зависимости от времени. Это позволило убрать из аппроксимационной функции слабоуправляемые или неуправляемые факторы.
Таким образом удалось достичь соответствия между математической и логической моделями. Были рассмотрены различные эпидемиологические ситуации: небольшое число пациентов (с выявленным возбудителем) за определенный период, среднее и большое число пациентов за такой же период. Предполагалось, что схема лечения и режим приема антибиотика оставались более или менее однородными внутри конкретной ситуации. Для каждой ситуации были построены линейные зависимости роста ОР от времени, имеющие вид: OP = A•t + b, где А - скорость роста резистентности, b - константа. Из массива скоростей, полученных при рассмотрении различных эпидемиологических ситуаций, выбрали минимальную скорость. Далее полученная функция ФР была скорректирована на начальный усредненный уровень резистентности (ЕР), за который было принято среднее значение ОР в начале исследуемого периода времени (начало 2007 г.)
В дальнейшем планируется произвести более тщательную очистку ФР от прочих факторов с целью проверить предположение, что периоды со схожим числом пациентов характеризуются схожей интенсивностью применения антибиотика. Это позволит скорректировать аппроксимационную функцию для ФР, в частности - вывести коэффициенты влияния эпидемиологической ситуации и интенсивности применения антибиотика на развитие резистентности. Планируется также установить влияние сочетанного применения нескольких антибиотиков в процессе лечения.
Для проверки корректности модели был построен прогноз ОР на 2011-2012 гг. (на обучающей выборке 2007-2010 гг.) и проведено его сравнение с фактической ОР. Для этого сначала была восстановлена ФР по описанному ранее алгоритму (без привлечения данных за 2011-2012 гг. при нахождении минимальной скорости развития резистентности), а затем смоделирована и спрогнозирована ЭР как функция вида N • sin(I), где N - количество пациентов, I - интенсивность потребления антибиотика (интенсивность определяли эмпирически по известной формуле ЭР = ОР-ФР и N).
При таком построении мы восстановили периодический вид ЭР и учли предполагаемое влияние факторов N и I на ОР: при возрастании I - увеличение ОР, при увеличении N - уменьшение ОР за счет большей доли отвечающих на антибиотики пациентов (эмпирически выявлено, что при увеличении числа пациентов доля чувствительных штаммов возрастает, тогда как в абсолютных величинах число резистентных штаммов не убывает).
Далее был установлен темп роста ЭР (дельта ЭР) от года к году, рассчитываемый как среднегодовой прирост средней ЭР для разных лет. Аналогичная процедура была проведена для оценки темпа роста ФР (дельта ФР). На основании полученных коэффициентов и дельт были спрогнозированы ФР, ЭР и ОР как сумма ФР и ЭР.
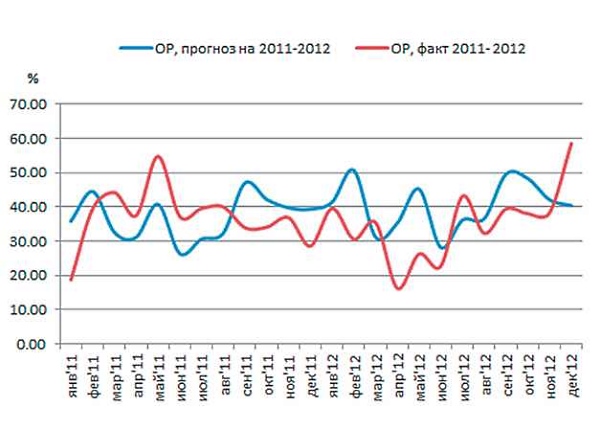
Рис. 1. Результаты валидации на примере E.coli и ципрофлоксацина. ОР - общая резистентность.
На рис. 1 представлены результаты проверки качества модели. Приведены фактическая ОР за 2011-2012 гг. и прогноз, построенный на данных 2007-2010 гг. Абсолютная погрешность прогноза на 2011 г составила 26,2%, на 2012 - 29,3%.
При пересчете коэффициентов с учетом 2011 г., (т.е. обучающая выборка 2007-2011гг.) абсолютная погрешность прогноза на 2012 г. составила 29,4%, что практически не отличается от предыдущего прогноза. Столь незначительная разница говорит о том, что на данном этапе без знания фактической интенсивности потребления антибиотика, а также без понимания того, как может измениться этот показатель в прогнозном периоде, нельзя улучшить качество прогноза.
Подобная модель была применена к нескольким антибиотикам.
Ципрофлоксацин
Приведенная на рис. 2 ЭР вычислялась как разность между ОР и ФР, где ФР рассчитана по данным всего периода 2007-2012 гг. Как видно из рисунка, самое большое расхождение между прогнозом и фактической ЭР приходится на 2-й квартал и на декабрь 2012 г. Недостаточная точность прогноза обусловлена тем, что при его составлении была использована средняя фактическая интенсивность потребления антибиотика за прошлые периоды, тогда как в 2012 г. эта интенсивность существенно изменилась. Это хорошо видно на рис. 3.
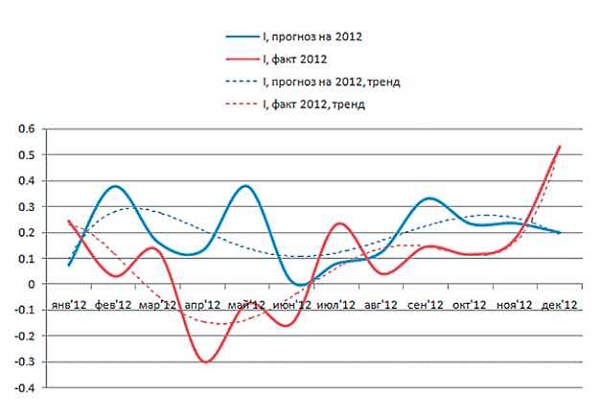
Рис. 3. Интенсивность потребления ципрофлоксацина в 2012 г., факт и прогноз.
В качестве фактической интенсивности выступал коэффициент, полученный из функции ЭР = N • sin(I) = ОР—ФР, а в качестве прогноза -усредненная интенсивность за прошлые годы. Пунктирными линиями обозначены тренды (сглаженное изменение уровня потребления антибиотика). Из-за сильного изменения интенсивности потребления антибиотика по отношению к прошлым периодам возникло расхождение между фактической и прогнозируемой общей резистентностью (ОР) в 2012 г.
Что касается ФР, то по этому параметру разница между фактом и прогнозом оказалась незначительной (рис. 4).
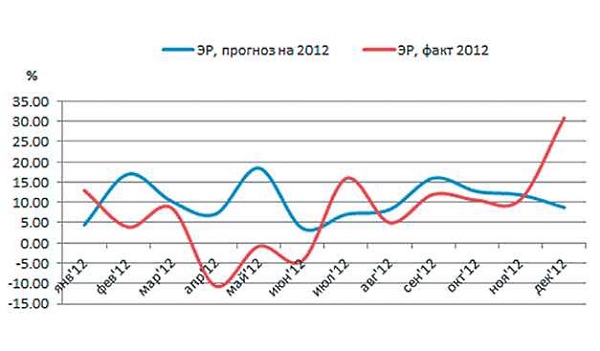
Рис. 2. Энтропийная резистентность (ЭР) E.coli к ципрофлоксацину в 2012 г., факт и прогноз.
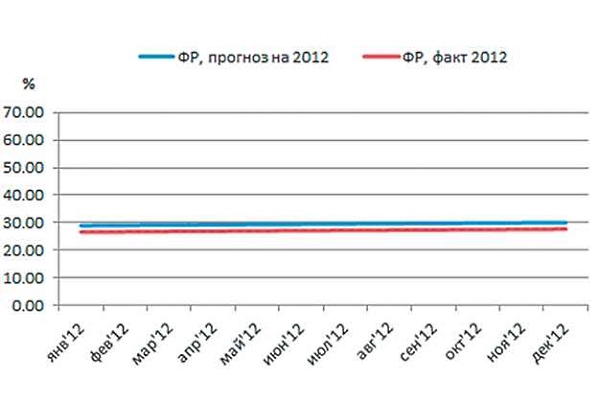
Рис. 4. Фоновая резистентность (ФР) E.coli к ципрофлоксацину в 2012 г., факт и прогноз.
В заключение был рассчитан прогноз ОР на 2013 г. с использованием всех данных за 2007-2012 гг. (рис. 5).
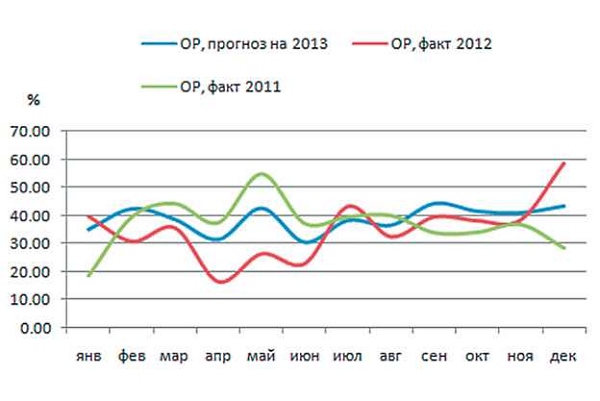
Рис. 5. Общая резистентность (ОР) E.coli к ципрофлоксацину, прогноз на 2013 г. Для наглядности представлена также фактическая ОР за 2011 и 2012 гг.
Ампициллин
Здесь, в отличие от ципрофлоксацина, не обнаружено значительных расхождений между фактической и прогнозируемой ОР (абсолютная погрешность за 2011 г. - 9,7%, за 2012 г. - 17,8%). Основная ошибка обусловлена неучтенным в модели запаздыванием влияния на ЭР изменений в интенсивности потребления ампициллина. Эти изменения показаны на рис. 7.
В качестве фактической интенсивности выступал коэффициент, полученный из функции ЭР = N sin(I) = ОР - ФР, а в качестве прогноза - усредненная интенсивность за прошлые годы. Пунктирными линиями обозначены тренды.
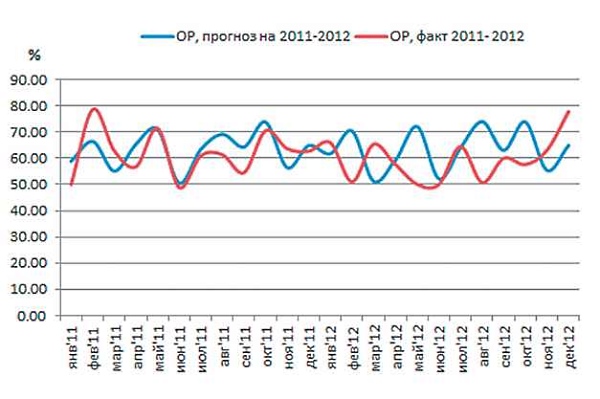
Рис. 6. Общая резистентность (ОР) E.coli к ампициллину в 2011-2012 гг., факт и прогноз.
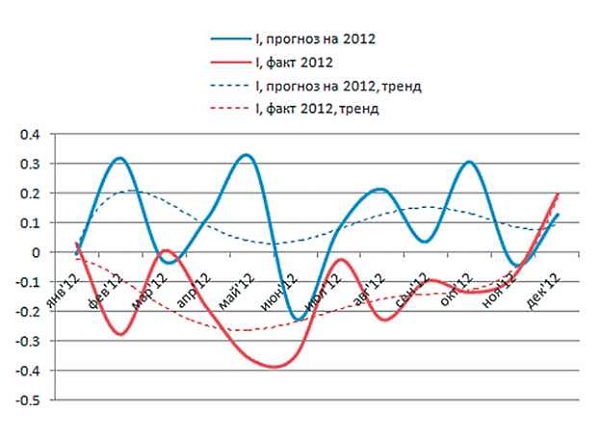
Рис. 7. Интенсивность потребления ампициллина в 2012 г., факт и прогноз.
Как видно данных, представленных на рис. 7, прогноз потребления ампициллина оказался завышен по отношению к факту; соответственно, был сделан вывод, что в 2012 г. потребление ампициллина снизилось по сравнению с предыдущими периодами (прогноз интенсивности на 2012 г. строился как средняя интенсивность за 2009-2011 гг.).
Несмотря на значительное расхождение между фактом и прогнозом интенсивности, из рис. 6 видно, что прогноз ОР сделан с достаточно высокой точностью. Объяснение этому показано на рис. 8: уровень ФР к ампициллину в 2012 г. составил около 70%, и прогноз близок к факту. То есть ЭР оказывает меньшее влияние на ОР в результате устоявшегося высокого уровня ФР. Другими словами, практически вся ОР является устойчивой ФР, а ЭР вносит незначительные изменения в развитие ОР в силу сложившихся схем лечения с применением данного антибиотика.
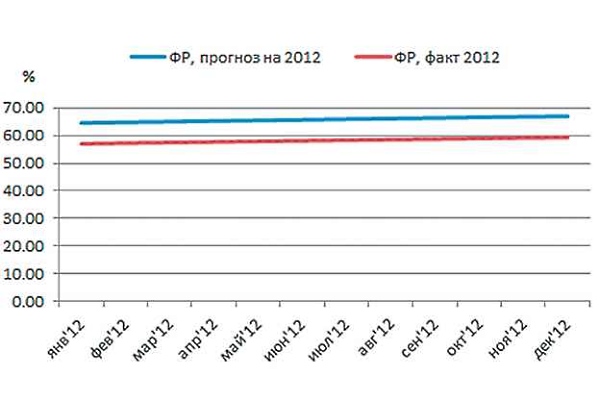
Рис. 8. Фоновая резистентность (ФР) E.coli к ампициллину в 2012 г., факт и прогноз.
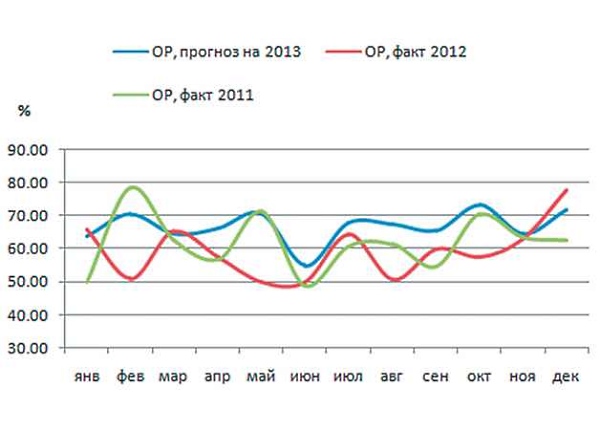
Рис. 9. Общая резистентность (ОР) E.coli к ампициллину, фактическая в 2011 и 2012 гг. и прогноз на 2013 г.
На основании оценок ФР было проведено сравнение ряда антибиотиков по скорости роста ФР. На рис. 10 представлены восстановленные (очищенные от влияния прочих факторов) функции фоновой резистентности к отдельным антибиотикам; о скорости роста ФР можно судить по углу наклона функции (чем больше наклон в сторону оси ординат - тем выше скорость).
Из представленных на рис. 10 данных видно:
- кривые, описывающие ФР E.coli к антибиотикам одной группы и одного механизма действия (цефтазидим и цефотаксим), совпадали;
- оптимальным по критерию скорости образования резистентности оказался фосфомицин (на графике не представлен, т. к. ФР равна нулю);
- наибольшую скорость образования резистентности индуцировал ампициллин.
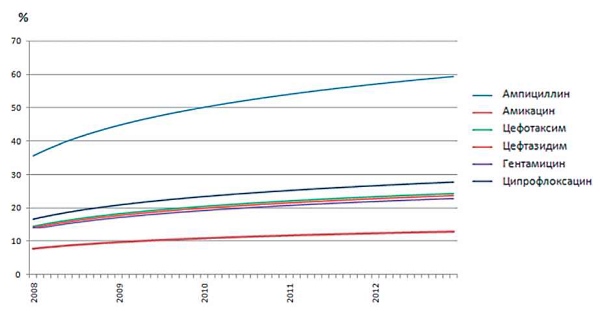
Рис. 10. Динамика фоновой резистентности (ФР) E.coli к ряду антибиотиков (2007-2012 гг).
Выводы
Основные результаты проведенной работы:
- построена модель распространения общей резистентности к антибиотикам;
- сформирована функция аппроксимации для общей резистентности;
- создан метод прогноза общей резистентности;
- сформирована шкала для определения оптимального антибиотика по критерию роста фоновой резистентности.
В дальнейшем планируются:
- модификация модели для внутри- и внебольничных возбудителей;
- исследование связи между интенсивностью применения антибиотиков и эпидемиологической ситуацией;
- корректировка коэффициента фоновой резистентности с использованием фактической общей резистентности, очищенной от влияния такого фактора как интенсивность применения антибиотиков;
- поиск лучшей аппроксимационной функции для энтропийной резистентности;
- формирование функциональной зависимости интенсивности применения антибиотика от препарата, его дозировки и длительности приема;
- детальное изучение энтропийной резистентности для имитационного моделирования;
- сопоставление результатов анализа по различным стационарам.
В результате должна быть получена более точная функция для прогноза резистентности при различных входных данных. Это позволит не только прогнозировать время, когда уровень резистентности к антибиотику будет слишком высок (чтобы вовремя перейти на более эффективный антибиотик), но и найти оптимальную схему лечения, при которой развитие резистентности с течением времени будет минимальным.
Литература:
1. De Leenheer P., Dockery J., Gedeon T., et al. Senescence and antibiotic resistance in an age-structured population model. J Math Biol. 2010; 61 (4): 475-499.
2. REX Consortium. Structure of the scientific community modelling the evolution of resistance. PLoS One. 2007; 2 (12): e1275.
3. Temime L., Hejblum G., Setbon M., et al. The rising impact of mathematical modelling in epidemiology: antibiotic resistance research as a case study. Epidemiol Infect. 2008; 136 (3): 289-298.
4. Sun L., Klein E., Laxminarayan R. Seasonality and temporal correlation between community antibiotic use and resistance in the United States. Clin Infect Dis. 2012; 55 (5): 687-694.
5. Zur Wiesch P.A., Kouyos R., Engelstadter J., et al. Population biological principles of drug-resistance evolution in infectious diseases. Lancet Infect Dis. 2011; 11 (3): 236-247.
6. Yeh P.J., Hegreness M.J., Aiden A.P., et al. Drug interactions and the evolution of antibiotic resistance. Nat Rev Microbiol. 2009; 7 (6): 460-466.
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии


