| Новости | e-Образование | Врачебные Общества | Тематические группы | Библиотека | Медиатека | Мероприятия | Атлас |
Присоединяйтесь!
- Повышение квалификации
- Сертифицированное образование
- Актуальные статьи
- Обзоры и репортажи
- Клинические случаи
- Новости медицины
- Советы коллег
Сообщество: Оценка Медицинских Технологий
Стандартизация процесса экспертизы перечней лекарственных препаратов с использованием автоматизированных систем
М.В. Сура
Национальный центр по оценке технологий в здравоохранении, Москва, Россия
Центр оценки технологий в здравоохранении Российской академии народного хозяйства и государственной службы при Президенте РФ, Москва, Россия
Факультет управления и экономики здравоохранения Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава РФ, Москва, Россия
В.В. Омельяновский
Национальный центр по оценке технологий в здравоохранении, Москва, Россия
Центр оценки технологий в здравоохранении Российской академии народного хозяйства и государственной службы при Президенте РФ, Москва, Россия
А.В. Маргиева
Национальный центр по оценке технологий в здравоохранении, Москва, Россия
Актуальность
Перечни лекарственных препаратов, формулярные списки, перечни основных лекарств, ограничительные перечни и т.д. – все эти термины с их многочисленными определениями вот уже не одно десятилетие присутствуют в качестве важной составляющей системы лекарственного обеспечения в нашей стране. Перечни формируются на разных уровнях системы здравоохранения, различаются по функциям, качественному и количественному наполнению. Их формируют различные экспертные структуры, использующие свои правила принятия решений и критерии оценки лекарственных препаратов (ЛП), зачастую не закрепленные ни в каких нормативных документах или даже носящие чисто декларативный характер [1, 2].
Отсутствие научно обоснованных, единых, стандартизованных механизмов формирования списков не позволяет этой системе гарантировать закупку действительно эффективных, экономически приемлемых ЛП и исключить нерациональное расходование государственных средств на лекарственное обеспечение населения. Двадцатилетний период, прошедший со дня утверждения первого отечественного перечня жизненно необходимых и важнейших лекарственных препаратов (ПЖНВЛП), кажется достаточным, чтобы, наконец, принять и утвердить единые правила включения препаратов в списки и стандартизировать (унифицировать) процесс принятия решений и критерии экспертной оценки.
Одним из важных шагов на пути повышения эффективности системы, ответственной за формирование перечней ЛП, может стать их всесторонняя клиническая и экономическая экспертиза. В 2012 г. в НИИ клинико-экономической экспертизы и фармакоэкономики РНИМУ им. Н.И. Пирогова была разработана и апробирована автоматизированная система экспертизы ограничительных перечней лекарственных препаратов «ФармЭк» (далее система), представляющая собой интернет-систему стандартизованной междисциплинарной экспертизы перечней ЛП различных уровней и функционального назначения. Разработка данной системы стала логичным продолжением работы НЦ ОТЗ по созданию автоматизированных систем формирования и экспертизы перечней лекарственных препаратов, в частности программы ФармКомпайл «АВС/VEN/DDD-анализ» и автоматизированной системы по формированию ограничительных перечней «Досье» [3].
Описание автоматизированной системы экспертизы ограничительных перечней лекарственных препаратов «ФармЭк»
«ФармЭк» представляет собой многопользовательскую интернет-систему, вход в которую осуществляется через уникальные логиныи пароли (рис. 1). Система обеспечивает проведение стандартизованной, многоуровневой, междисциплинарной экспертизы перечней ЛП по определенному набору заданных критериев оценки в режиме on-line.
Рис. 1. Главная страница автоматизированной системы экспертизы ограничительных перечней лекарственных препаратов «ФармЭк»
Экспертиза перечня – многоэтапный процесс, в котором участвует неограниченное количество специалистов – экспертов различного профиля: клинические фармакологи, клиницисты, специалисты в области доказательной медицины (рис. 2). Процесс экспертизы и связь с экспертами поддерживает руководитель экспертизы, который имеет максимальный доступ ко всем разделам системы: проводит первичный («АВС/ VEN (формальный) /DDD) анализ перечня, вводит перечень в систему, назначает экспертов и предоставляет им пароли доступа, следит за ходом выполнения экспертизы, а также анализирует полученные результаты, формируя итоговое согласованное экспертное заключение.
АВС-анализ перечня ЛП – метод распределения ЛП по доле затрат на каждое из них в общей структуре расходов от наиболее затратных к наименее затратным в соответствии с их фактическим потреблением за предыдущий период с выделением трех групп: группа А – ЛП, на которые расходуется 80 % бюджета; группа В – ЛП, на которые расходуется 15 % бюджета; группа С – ЛП, на которые расходуется 5 % бюджета, выделяемого на закупку ЛП.
VEN-анализ перечня ЛП – распределение ЛП по степени их значимости на жизненно важные (Vital; V), необходимые (Essential; E) и второстепенные (Non-essential; N). Формальный подход предполагает сравнение анализируемого перечня с утвержденными нормативными документами; экспертный – заключение экспертов относительно жизненной важности ЛП. DDD-анализ перечня ЛП – анализ количества потребленных DDD.
DDD (Defi ned Daily Dose) – расчетная средняя поддерживающая суточная доза ЛП, применяемого по основному показанию у взрослых.
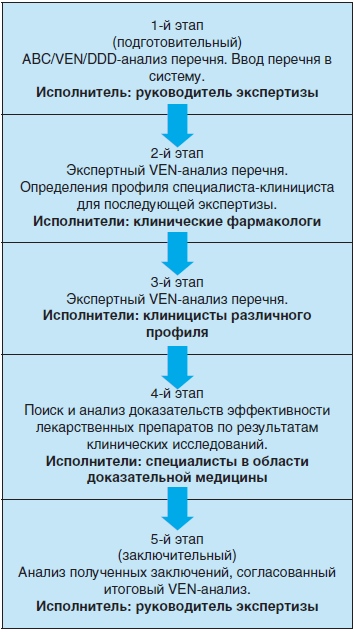
Рис. 2. Алгоритм экспертизы перечней лекарственных препаратов в рамках автоматизированной системы «ФармЭк».
При вводе перечня в систему его необходимо оформить согласно определенному шаблону, который в максимальном своем объеме включает следующие разделы:
- международноенепатентованноеназвание (МНН);
- торговое название (ТН);
- результаты ABC-анализа (группа ЛП – А, ВилиС, затраты (руб.), доля затрат на каждый ЛП);
- результаты формального VEN-анализа, проведенного согласно действующему ПЖНВЛП и перечню, действующему в рамках программы обеспечения необходимыми лекарственными препаратами (ОНЛП);
- результаты DDD-анализа, коды классификации МКБ-10, по которым выписывались ЛП.
При необходимости количество вводимых в систему разделов шаблона может быть сокращено до минимума, например только до названий (МНН и ТН) препаратов. Шаблоны с максимальным объемом вносимой в систему информации можно подготовить, используя программу ФармКомпайл «АВС/VEN/DDDанализ».
После внесения перечня в систему руководитель экспертизы назначает клинических фармакологов (до 3 специалистов) для проведения экспертного VENанализа перечня. Наряду с определением индексов жизненной важности ЛП, клинические фармакологи выбирают, каких по профилю клиницистов следует впоследствии привлечь к дополнительному проведению экспертного VEN-анализа перечня по конкретным фармакотерапевтическим группам. Уведомление о том, что эксперт может приступить к работе, а также логины и пароли доступа в систему отправляются в автоматическом режиме на адрес электронной почты назначенного эксперта.
Как клинические фармакологи, так и клиницисты при определении индексов жизненной важности ЛП в рамках проведения VEN-анализа должны следовать определенным стандартизованным критериям принятия решения, подтверждая выбранные критерии фактологическим материалом, в частности стандартами медицинской помощи, отечественными и/или международными рекомендациями по лечению, результатами клинических и клинико-экономических исследований и др. (рис. 3).
Рис. 3. Критерии решения экспертов (клинических фармакологов и клиницистов) при проведении VEN-анализа в рамках автоматизированной системы «ФармЭк».
После проведения экспертного VEN-анализа клиническими фармакологами и клиницистами к экспертизе приступают специалисты в области доказательной медицины. Для них руководитель экспертизы определяет перечень ЛП, итоговая оценка которых оказалась затруднительной в связи со значительными расхождениями в заключениях экспертов (например, несовпадение индексов жизненной важности, противоположные суждения и аргументы клиницистов и клинических фармакологов по одному и тому же препарату). В таких спорных случаях специалист по доказательной медицине на основании поиска и анализа клинических исследований определяет уровни доказательности эффективности ЛП, используя специальную шкалу, отмечая соответствующие уровни и аргументируя свой выбор результатами конкретных клинических исследований (рис. 4).

Рис. 4. Шкала уровней доказательности эффективности лекарственных препаратов, используемая специалистом по доказательной медицине в рамках автоматизированной системы «ФармЭк».
Заключительный этап экспертизы предполагает анализ всех полученных в результате формального и экспертного VEN-анализа индексов жизненной важности ЛП в перечне и определение согласованного итогового индекса жизненной важности каждого ЛП. В среднем в экспертизе одного перечня лекарственных препаратов, включающего 300–350 ЛП по МНН, участвуют 17–20 специалистов различного профиля, при этом по каждому ЛП может быть представлено от 3 до 6 экспертных заключений (с учетом результатов формального VEN-анализа количество индексов для отдельных препаратов может увеличиться до 8) (рис. 5).

Рис. 5. Результаты VEN-анализа препарата адалимумаб, проведенного в рамках автоматизированной системы «ФармЭк».
Условные обозначения:
ПЖНВЛП: N – препарат не включен в перечень ПЖНВЛП.
ОНЛП: N – препарат не включен в перечень ОНЛП.
КФ1: V – клинический фармаколог 1 оценил препарат как жизненно важный.
КФ2: E – клинический фармаколог 2 оценил препарат как необходимый.
Клиницист (ревматолог): V – ревматолог оценил препарат как жизненно важный.
Итоговое заключение, V – на основании анализа заключений экспертов и всех индексов жизненной важности принято согласованное заключение, что препарат является жизненно важным.
Важной интеллектуальной составляющей системы «ФармЭк» является так называемый Справочник лекарственных препаратов, включающий в настоящее время экспертные заключения примерно на 400 ЛП по МНН. Справочник объединяет результаты проведенных экспертиз перечней ЛП (индексы жизненной важности, а также заключения экспертов – клинических фармакологов, клиницистов, специалистов по доказательной медицине). Каждый вновь вносимый в систему «ФармЭк» перечень автоматически проходит через «фильтр» Справочника, при этом происходит сверка ЛП перечня и Справочника и при совпадении МНН – обмен экспертной информацией (данные из Справочника автоматически присоединяются к анализируемому перечню). Это в значительной мере сокращает временные затраты на экспертизу новых перечней ЛП и уменьшает число необходимых для экспертизы специалистов. Информация в Справочнике может при необходимости обновляться.
В настоящее время система «ФармЭк» полностью готова к работе и прошла этап апробации в рамках экспертизы региональных перечней лекарственных препаратов для обеспечения льготных категорий граждан на амбулаторном этапе.
Одним из перспективных направлений дальнейшего совершенствования системы «ФармЭк» может стать включение в нее различного рода справочной информации: стандартов медицинской помощи, клинических рекомендаций, данных клинических исследований, являющихся основой для принятия экспертных решений. Все это будет способствовать дальнейшей унификации и стандартизации процесса экспертизы перечней лекарственных препаратов и принятию решений на основании единых качественных информационно-справочных материалов.
Апробация автоматизированной системы экспертизы ограничительных перечней лекарственных препаратов «ФармЭк»
Система «ФармЭк» в 2012 г. была апробирована в одном из регионов России в рамках экспертизы регионального перечня ЛП для обеспечения льготных категорий граждан на амбулаторном этапе (далее – «перечень региональной льготы»). Данный регион характеризуется высоким уровнем финансирования системы здравоохранения (подушевой норматив финансирования региональной программы государственных гарантий оказания бесплатной медицинской помощи в 2012 г. превысил 20 000 руб.).
Целью экспертизы являлась оптимизация перечня региональной льготы для повышения клинико-экономической эффективности закупок лекарственных препаратов.
В экспертизе перечня региональной льготы приняли участие 20 специалистов-экспертов различного профиля, включая клинических фармакологов, клиницистов, специалистов по доказательной медицине, организаторов здравоохранения.
В ходе экспертизы были проведены: АВС/VEN (формальный) /DDD-анализ перечня региональной льготы, экспертный VEN-анализ перечня с участием клинических фармакологов и клиницистов различного профиля. Кроме того, по ЛП, в отношении которых имелись значительные расхождения в заключениях экспертов, проводился поиск и анализ доказательств их эффективности. В заключение были определены итоговые согласованные индексы жизненной важности ЛП на основании обобщения данных формального и экспертного VEN-анализа, а также подготовлены рекомендации по оптимизации перечня региональной льготы. Таким образом, анализируемый перечень прошел через все 5 этапов экспертизы системы «ФармЭк». На экспертизу был представлен перечень региональной льготы, включивший 311 ЛП по МНН. Перечень содержал информацию о МНН, торговых наименованиях, лекарственных формах, количестве закупленных упаковок, стоимости упаковки, кодах МКБ-10, по которым были отпущены ЛП, а также о фирмах-производителях. Шаблон, необходимый для внесения перечня в систему «ФармЭк» с результатами АВС/VEN/DDD-анализа, был подготовлен с использованием программы ФармКомпайл «АВС/VEN/ DDD-анализ». Результаты АВС-анализа перечня региональной льготы представлены в табл. 1.
Таблица 1. Результаты АВС-анализа перечня региональной льготы
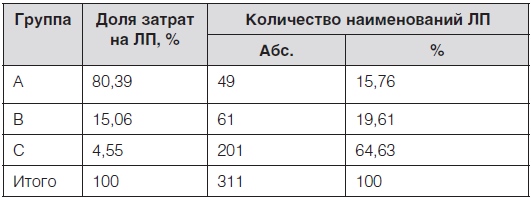
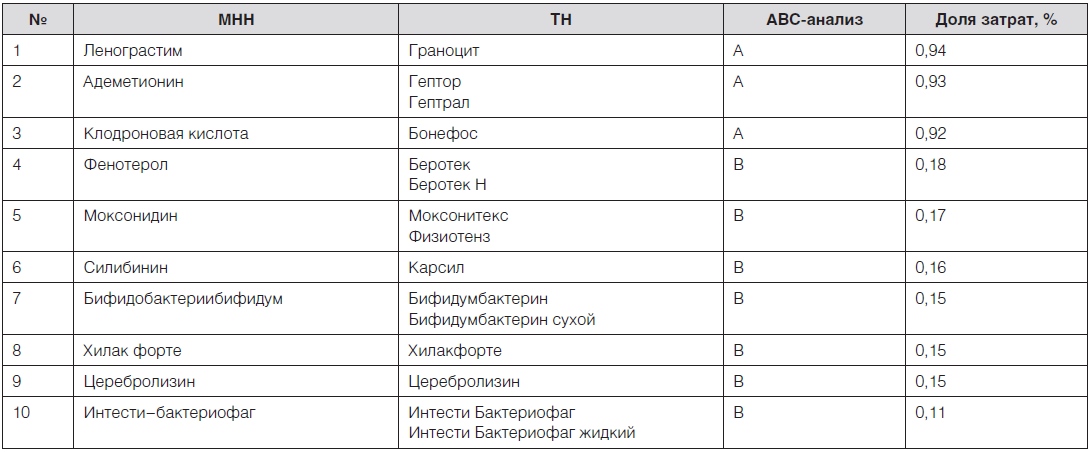
Как видно из приведенных данных, в наиболее затратной группе А (80,39 % затрат) оказалось 49 (15,76 %) ЛП, включенных в перечень, в группе В (15,06 % затрат) – 61 (19,61 %) ЛП, в группеС (4,55 % затрат) – 201 (64,63 %) ЛП. Первые 10 наиболее затратных ЛП представлены в табл. 2.
Таблица 2. Первые 10 наиболее затратных лекарственных препаратов группы А (80,39 % затрат), закупленных по перечню региональной льготы
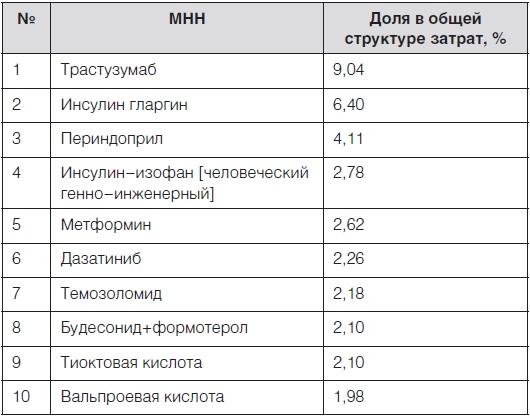
Проведенный DDD-анализ перечня региональной льготы представляет картину потребления 248 ЛП (79,7 %) из общего количества препаратов, включенных в перечень (на 63 ЛП перечни DDD пока не разработаны). В ходе DDD-анализа было показано, что в группу А (80 % потребленных DDD) вошли 16 ЛП.
При этом наибольшее количество потребления приходилось на группу кардиологических (лизиноприл, периндоприл, эналаприл, амлодипин, индапамд и др.) и эндокринологических (метформин, глибенкламид, гликлазид, глимепирид и др.) препаратов. Первые 10 ЛП с наибольшей частотой потребления представлены в табл. 3
Таблица 3. Перечень лекарственных препаратов с наибольшей частотой потребления среди региональных льготников
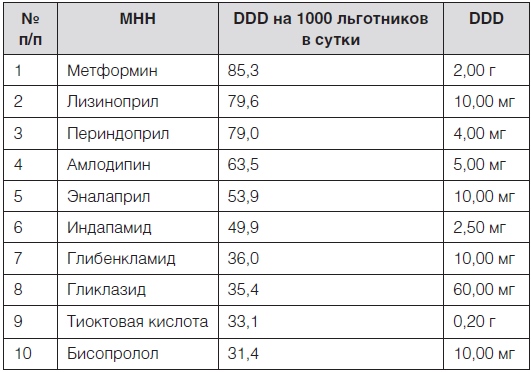
Среди всех ЛП максимальная частота потребления была у метформина – 85,3 DDD на 1000 льготников в сутки (т.е. 8,5 % льготников получали по 2 г метформина в сутки в течение года). За метформином с небольшим отставанием следовал ингибитор АПФ лизиноприл – 79,6 DDD на 1000 льготников в сутки (т.е. примерно 8 % льготников получали по 10 мг лизиноприла в сутки в течение года). Все 10 препаратов из перечня региональной льготы, характеризующиеся наибольшей частотой потребления, входят в ПЖНВЛП и в перечень ОНЛП, а также были оценены экспертами как жизненно важные и необходимые. Отсутствие среди лекарств с наибольшей частотой потребления пульмонологической и онкологической групп препаратов обусловлено тем, что значительная их часть была исключена из анализа в связи с отсутствием на них данных по DDD.
На первом этапе экспертизы был также проведен формальный VEN-анализ, при котором перечень региональной льготы сравнивался с ПЖНВЛП и перечнем ОНЛП [4, 5]. Например, если препарат из перечня региональной льготы был также включен в ПЖНВЛП, то он «формально» считался жизненно важным и ему присваивался индекс V, если же нет – то второстепенным с индексом N. Результаты АВС и формального VEN-анализа представлены в табл. 4.
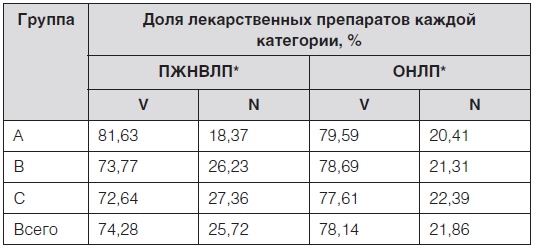
Таблица 4. Результаты ABC и формального VENанализов перечня региональной льготы
* Примечание:
V – жизненно важный ЛП;
N – второстепенный ЛП;
ПЖНВЛП – перечень жизненно необходимых и важнейших лекарственных препаратов;
ОНЛП – перечень, действующий в рамках программы обеспечения необходимыми лекарственными препаратами.
Согласно полученным данным, доля ЛП, относящихся к категории жизненно важных, колебалась в зависимости от сравниваемого перечня от 74,28 % (83,82 % затрат) до 78,14 % (84,22 % затрат), а второстепенных – от 21,86 % (15,78 % затрат) до 25,72 % (16,18 % затрат). При этом наибольшее количество препаратов с индексом N как при сравнении с ПЖНВЛП, так и с перечнем ОНЛП, было в наименее затратной группе С, а наименьшее – в наиболее затратной группе А. Таким образом, согласно формальной оценке жизненной важности ЛП в перечне региональной льготы, более 70 % этих ЛП и более 80 % денежных средств уходило на закупку жизненно важных препаратов. Результаты АВС и экспертного VEN-анализа представлены в табл. 5.
Таблица 5. Результаты ABC и экспертного VEN-анализов перечня региональной льготы
Согласно заключениям экспертов относительно жизненной важности ЛП, включенных в перечень, наибольшее количество второстепенных (N) препаратов было в наименее затратной группеС (от 6,47 % до 26,87 %), а наименьшее − в наиболее затратной группе А (от 0 % до 16,33 %). Результаты, обобщающие заключения экспертов по всем группам перечня (А, В иС), показали, что доля второстепенных (N) препаратов варьировалась в диапазоне от 5,47 % до 23,47 %, при колебании в затратах от 0,63 % до 11,13 %.
Что касается ЛП, в отношении которых имелись значительные расхождения в экспертных заключениях, то анализ, проведенный специалистами по доказательной медицине, выявил отсутствие надежных доказательств эффективности таких препаратов, как гопантеновая кислота, циннаризин, пирацетам, клонидин и др., что делает закупки этих ЛП в рамках перечня региональной льготы нецелесообразными.
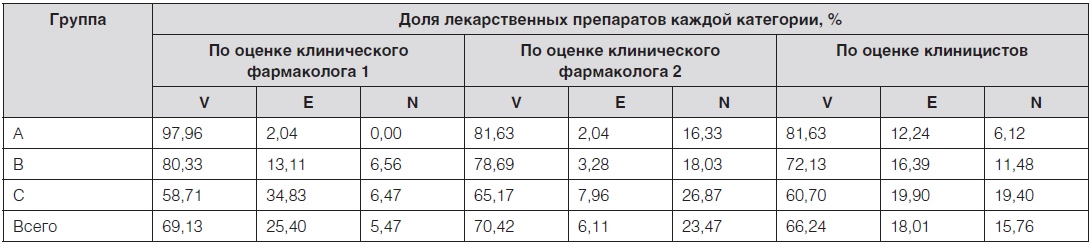
Выполненный на завершающем этапе экспертизы итоговый анализ всех экспертных заключений и данных формальногоVEN-анализа показал, что 66,56 % всех ЛП (89,93 % затрат), вошедших в перечень региональной льготы, были жизненно важными, 17,68 % (5,37 % затрат) необходимыми и 15,76 % (4,69 % затрат) второстепенными, что в наибольшей мере коррелировало с заключениями клиницистов (рис. 6). При этом в наиболее затратной группе А было только 3 второстепенных ЛП − ленограстим, адеметионин и клодроновая кислота, и на них пришлось менее 3 % от общих затрат на ЛП, закупленные в течение года.
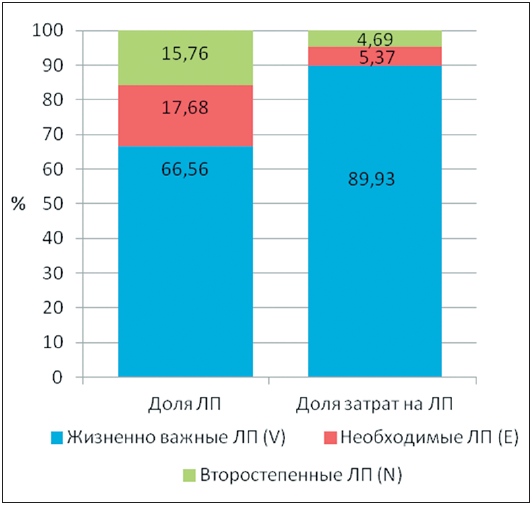
Рис. 6. Результаты итогового согласованного экспертного VEN-анализа перечня региональной льготы.
Таким образом, доля жизненно важных и необходимых ЛП в перечне региональной льготы составила, по согласованному экспертному заключению, 84,24 %, и на них было затрачено 95,31 % всех денежных средств.
Несмотря на в целом, благоприятную картину закупок ЛП в рамках региональной льготы, в ходе экспертизы перечня были определены 49 лекарственных препаратов, которые следует исключить (с заменой или без замены) из перечня. В табл. 6 представлены 10 наиболее затратных ЛП, рекомендованных к исключению из перечня.
Таблица 6. Перечень 10 наиболее затратных лекарственных препаратов, рекомендованных к исключению из перечня региональной льготы
Исключение (с заменой или без замены) данных препаратов из перечня региональной льготы было рекомендовано по разным основаниям. Так, часть препаратов не имела надежных доказательств эффективности (адеметионин, клодроновая кислота, силибинин, хилак форте, церебролизин и др.), другие были экономически нецелесообразными (ленограстим) в виду наличия на рынке более клинико-экономически выгодных альтернатив. При этом некоторые ЛП можно было бы заменить на более эффективные и безопасные (например, клодроновую кислоту − на золедронат, ибандронат) или экономически целесообразные терапевтические аналоги (например, ленограстим − на филграстим), другие же были рекомендованы к исключению без замены.
В целом, доля второстепенных ЛП в общей структуре перечня составила 15,76 %, а в структуре затрат − 4,69 %. Отказ от закупок этих препаратов или их замена на более эффективные и экономически целесообразные терапевтические аналоги в последующем может привести к дополнительной экономии финансовых средств.
Заключение
РассмотренныйподходкоценкеперечнейЛП, включающий стандартизацию экспертной оценки, вовлечение в процесс специалистов различного профиля, автоматизацию процесса экспертизы, а также унификацию критериев оценки ЛП и принятия решений, дает возможность повысить эффективность системы формированияперечнейЛПнаразличныхуровняхсистемыздравоохранения. Научно обоснованная экспертиза уже существующих перечней ЛП и повышение прозрачности принимаемых решений благодаря использованию автоматизированных систем позволят определить наиболее оптимальные − клинически и экономически − варианты перечней, что будет способствовать экономии бюджетных средств с одновременным повышением качества оказания медицинской помощи населению.
Литература:
1. Омельяновский В.В., Авксентьева М.В., Солдатова И.Г., Сура М.В., Зорин Н.А., Крысанов И.С. Клиническая и экономическая экспертиза при формировании перечней лекарственных средств. Медицинские технологии. Оценка и выбор. 2010; №1: 28–31.
2. Сура М.В., Омельяновский В.В. Эволюция системы экспертизы при формировании Перечня жизненно необходимых и важнейших лекарственных препаратов. Медицинские технологии. Оценка и выбор. 2011; №3 (5): 30–33.
3. Сура М.В., Омельяновский В.В. Правила работы в автоматизированной системе по формированию ограничительных перечней «Досье». Медицинские технологии. Оценка и выбор. 2012; №1 (7): 24–31.
4. Распоряжение Правительства РФ от 07.12.11 г. №2199-р. Перечень жизненно необходимых и важнейших лекарственных препаратов.
5. Приказ Минздравсоцразвития России от 18.09.2006 г. №665 в ред. Приказов Минздравсоцразвития РФ от 19.10.2007 №651, от 27.08.2008 №451н, от 01.12.2008 №690н, от 23.12.2008 №760н. Перечень лекарственных средств, отпускаемых по рецептам врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан, имеющим право на получение государственной социальной помощи.
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии